
下列叙述正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4
B.25℃时Ksp(AgCl)=1.8×10—10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大
C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4
D.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸
C
【解析】
试题分析:A、醋酸是弱酸,所以在稀释的过程中,会促进醋酸的电离,使氢离子浓度减小程度减弱,则溶液的pH小于4,错误;B、AgCl程度存在溶解平衡,加入NaCl固体后于溶液中的氯离子的浓度增大,使溶解平衡逆向移动,则AgCl的溶解度减小,错误;C、浓度相同时,氢氧化钠是强碱,所以氢氧根离子浓度最大,碳酸根离子水解使溶液呈碱性,铵根离子水解使硫酸铵溶液呈酸性,硫酸氢钠在水中完全电离产生钠离子、氢离子、硫酸根离子,酸性最强,所以pH的大小顺序是NaOH>Na2CO3>(NH4)2SO4>NaHSO4,正确;D、NaHA是酸式盐,若为强酸,则其水溶液一定为酸性,pH<7,但为弱酸时,既存在HA-的电离也存在其水解,二者程度的大小共同决定溶液的酸碱性,pH<7,也可能是弱酸,此时HA-的电离程度大于其水解程度,错误,答案选C。
考点:考查弱电解质的电离平衡、沉淀的溶解平衡、盐的水解的应用


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2014-2015学年安徽省安庆五校联盟高三下学期3月联考理综化学试卷(解析版) 题型:填空题
(16分)ZnO是电镀、涂料、有机合成等化学工业的重要原料。某课题组设计由含锌工业废料(含Fe、Cu、Mn等杂质)生产ZnO的工艺流程如下:

已知:黄钠铁矾在pH为1.5,温度为90℃时完全沉淀,且易于过滤。
2Cu +O2 +2H2SO4 == 2CuSO4+2H2O
(1)步骤①的浸取液里除含有Zn2+、Mn2+以外,还含有的金属离子有 、 ,所加试剂X为Na2SO4和_________的混合液。
(2)步骤②可进一步氧化除铁,还氧化除去了Mn2+,试写出相应的除去Mn2+的离子方程式_________________________,步骤③加入的试剂是_______,整个工艺流程中可以循环使用的试剂是_____________。
(3)步骤⑤中检验沉淀是否洗涤干净的操作方法是____________________________。
(4)步骤④碳化实际得到的是一种碱式碳酸锌[ZnCO3·xZn(OH)2·yH2O],取该样品7.18 g,充分灼烧后测得残留物质量为4.86 g,将所得气体通入足量澄清石灰水中,得到2.00 g沉淀,则此碱式碳酸锌的化学式是________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:填空题
(14分)为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) △H=—566kJmoL-1
2H2(g)+O2(g)=2H2O(g) △H=—483.6kJmoL-1
H2O(g)=H2O(l) △H=—44.0kJmoL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:___________________________。
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=—92.4kJ/mol
2NH3(g) △H=—92.4kJ/mol
当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。

①图中t3时引起平衡移动的条件可能是__________________________________________,其中表示平衡混合物中NH3的含量最高的一段时间是_____________。
②温度为T℃时,将1 mol N2和2 mol H2放入容积为0.5 L的密闭容器中,充分反应后测得N2的平衡转化率为50%。则反应在T℃时的平衡常数为____________mol-2·L2。
③目前工业合成氨的原理是:
下图表示随条件改变,平衡体系中氨气体积分数的变化趋势。

当横坐标为压强时,变化趋势正确的是(填序号,下同)__________,当横坐标为温度时,变化趋势正确的是___________。
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为_______>_______>_______>________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关物质分类的说法中,正确的是
A.SiO2不能和水反应,所以它不是酸性氧化物
B.只由一种元素组成的物质必然是纯净物
C.烧碱、冰醋酸、石墨均为电解质
D.海水、氯水、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北大冶一中等六校高三元月调考理综化学试卷(解析版) 题型:填空题
(15分)甲醇可作为燃料电池的原料。工业上利用CO2和H2在一定条件下反应合成甲醇。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。回答下列问题:
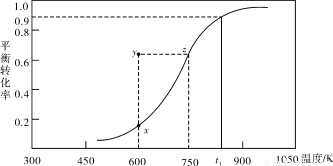
①600K时,Y点甲醇的υ(逆) (正)(填“>”或“<”)
②从Y点到X点可采取的措施是______________________________________。
③有同学计算得到在t1K时,该反应的平衡常数为8.1mol·L-1。你认为正确吗?请说明理由 。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。在相同的密闭容器中,使用不同方法制得的Cu2O(Ⅰ)和(Ⅱ)分别进行催化CH3OH的脱氢实验:CH3OH(g) HCHO(g)+H2(g)
HCHO(g)+H2(g)
CH3OH的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(H2)= ;实验温度
T1 T2(填“>”、“<”);催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,则Co2+在阳极的电极反应式为 ;除去甲醇的离子方程式为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:实验题
(16分)
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 molL-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 molL-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 molL-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 molL-1 FeCl3溶液中滴加2滴0.1 molL-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① molL-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i | ③ | 生成白色沉淀 |
ii | 向i所得溶液中滴加0.1 molL-1 FeCl3溶液 | ④ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
下列日常生活中的现象与氧化还原反应无关的是
A.铜铸塑像上出现铜绿[Cu2(0H)2C03]
B.用石膏点豆腐
C.不良商贩用硫黄熏蒸法制作“白豆芽”
D.自来水厂用氯气对水进行消毒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省六校教育研究会高三联考化学试卷(解析版) 题型:填空题
某大型精炼铜厂,在电解铜的阳极泥中含有3-14℅Se元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属。人体缺乏Se就会得“克山病”,Se也是制光电池的一种原料。从阳极泥中提取Se的流程如下:

(1)流程②的目的是_________________.流程④操作用到的玻璃仪器有烧杯、______________。
H2SeO3与SO2的离子反应方程式为 。
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。工业提取Se的流程中,可循环利用的物质是_________________。
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL.则电解铜阳极泥中Se的质量分数为____________。若用FeCl2溶液为Fe2+标准溶液滴至终点,对测定Se的质量分数结果是否有影响,理由是_____________。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省攀枝花市高一上学期期末考试化学试卷(解析版) 题型:计算题
(8分)某研究小组取一定质量的镁铝合金放入200mL稀硫酸中,固体完全溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的变化关系如图所示。

求:(1)该合金的质量
(2)原稀硫酸的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com