
【题目】在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)![]() xC(g);H=?符合下图(a)所示的关系。w(c)为C的质量分数,由此推断关于图(b)的说法正确的是
xC(g);H=?符合下图(a)所示的关系。w(c)为C的质量分数,由此推断关于图(b)的说法正确的是

A.P3>P4,y轴表示A的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的平均相对分子质量
D.P3>P4,y轴表示混合气体的密度
【答案】A
【解析】
根据图像a可知,当压强相等时,T1首先达到平衡状态,这说明温度是T1大于T2。即升高温度生成物C的含量是降低,因此升高温度,平衡向逆反应方向移动,则正反应是放热反应,△H小于0;当温度相等时,P2首先达到平衡状态,这说明P2大于P1,因此增大压强,C的含量是增大的,所以增大压强,平衡向正反应方向移动,即正反应是体积减小的,所以x=1。
A.升高温度,平衡向逆反应方向移动,A的转化率降低;增大压强,平衡向正反应方向移动,A的转化率增大,所以选项A正确;
B.升高温度平衡向逆反应方向移动,B的含量是增大的,所以选项B不正确;
C.增大压强,平衡向正反应方向移动,正反应是体积减小的,所以混合气的平均相对分子质量增大,所以选项C不正确;
D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以密度是不变的,选项D不正确。
答案选A。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是
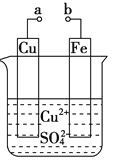
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
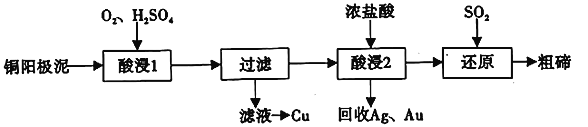
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组制备84消毒液(主要成分NaClO)设计了如图装置。并查阅到下列资料:

Ⅰ.氯气与水的反应是放热反应;
Ⅱ.卤素单质与碱液发生反应:3X2+6OH-![]() 5X-+XO3-+3H2O。
5X-+XO3-+3H2O。
回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为__。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?__(填“能”或“不能”,下同),理由是__。
(3)装置中能否省去盛浓硫酸的洗气瓶?__,理由是__。
(4)装置中能否省去盛冰水的烧杯?__,理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量CaCl2、MgCl2、Na2SO4等杂质,实验室提供的试剂如下:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液。实验室提纯NaCl的流程如图:

(1)欲除去溶液I中的杂质,写出A所代表的多种试剂,按滴加顺序依次为I.NaOH;Ⅱ.___________;Ⅲ.____________ (填化学式)。
(2)请写出下列试剂加入时发生反应的化学方程式:
①加入试剂I: ____________________________。
②加入盐酸:______________________________________________________.
(3)操作a、b中均用到的玻璃仪器是________、_______(填仪器名称),操作c的名称为___________________。
(4)如何对操作b所得到的沉淀进行洗涤:________________________。
(5)经过操作b后,如何检验所得溶液中的SO42-已除去:______________。
(6)若上述流程中未进行操作b,即直接向溶液I中加盐酸到pH为45,过滤,得到沉淀X和溶液Y,则沉淀X为__________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯(Pd)、锌及其化合物在合成酮类物质中有极其重要的作用,如图为合成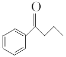 的反应过程:
的反应过程:
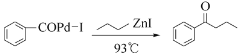
回答下列问题:
(1)I原子价电子排布式为___________,其能量最高的能层是___________(填能层符号)。
(2)H、C、O三种元素的电负性由大到小的顺序为___________。
(3) 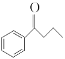 中碳原子的杂化方式为___________。
中碳原子的杂化方式为___________。
(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是___________。
②NH3的空间构型为___________。
③1 mol [Zn(NH3)4]Cl2中含有___________mol σ键。
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的___________。
(6)金属钯的堆积方式如图所示:
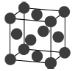
①该晶胞中原子的空间利用率为___________(用含π的式子表示)。
②若该晶胞参数a=658 pm,则该晶胞密度为___________(列出计算表达式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
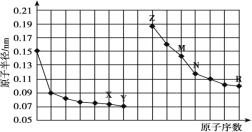
A.最高价氧化物对应水化物的碱性:Z<M
B.X、N 两种元素形成的化合物属于离子化合物
C.Y、R 两种元素气态氢化物的稳定性:Y>R
D.简单离子的半径:Z>M>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置如图所示。实验时在不锈钢舟内加入镁粉,通氮气15min,升温至1073K,加热半小时,冷却至室温,停止通氮气。下列说法正确的是( )
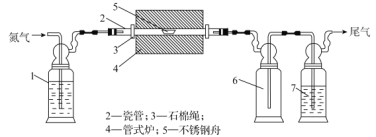
A.1中的试剂是饱和食盐水,便于观察气泡,调节气流速度
B.6的作用是缓冲加热后未反应的氮气,7的作用是防止空气中的水分进入装置
C.氮化镁是共价化合物,露置于空气中有刺激性气味的气体产生
D.实验中氮气是反应物,仅起到氧化镁粉的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com