
【题目】下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
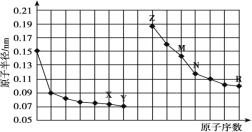
A.最高价氧化物对应水化物的碱性:Z<M
B.X、N 两种元素形成的化合物属于离子化合物
C.Y、R 两种元素气态氢化物的稳定性:Y>R
D.简单离子的半径:Z>M>X
【答案】C
【解析】
同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可以知道X为O元素,Y为F元素,Z为Na元素,M为Al元素,N为Si元素,R为Cl元素。
A.同周期元素从左到右元素的金属性逐渐减弱,金属性越强,对应的最高价氧化物对应水化物的碱性越强,所以碱性强弱为:Z>M,A错误;
B.X、N两种元素组成的化合物为二氧化硅,二氧化硅是由原子组成,属于共价化合物,B错误;
C.气态氢化物的稳定性和非金属性有关,非金属性越强,气态氢化物越稳定,非金属性Y>R,Y、R 两种元素气态氢化物的稳定性:Y>R,C正确;
D.离子电子层结构相同,核电荷数越大,离子半径越小,所以简单离子的半径:M<Z<X,D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:

(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定容积的密闭容器中,可发生以下反应:A(g)+B(g)![]() xC(g);H=?符合下图(a)所示的关系。w(c)为C的质量分数,由此推断关于图(b)的说法正确的是
xC(g);H=?符合下图(a)所示的关系。w(c)为C的质量分数,由此推断关于图(b)的说法正确的是

A.P3>P4,y轴表示A的转化率
B.P3<P4,y轴表示B的体积分数
C.P3<P4,y轴表示混合气体的平均相对分子质量
D.P3>P4,y轴表示混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.反应![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]() Fe(s)+CO2(g)H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
Fe(s)+CO2(g)H<0,在1000℃的平衡常数等于4.0.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.
(1)CO的平衡转化率= ______ 。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 ______
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
II.(1)高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇: CO(g)+2H2(g)CH3OH(g)。请根据图示回答下列问题:
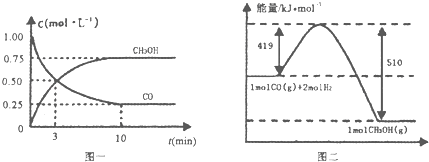
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= ______ 。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
乙 | 1molCH3OH | a2 | c2 | 吸收Q2kJ热量 |
丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是 ______ .
A c1=c2 B 2Q1=Q3 C 2a1=a3 D a1+a2=1 E 该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同。试回答:
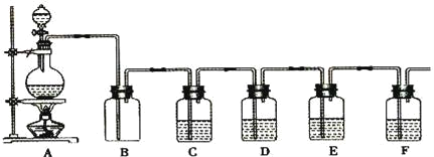
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:____,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为__、__、__、__、__,E中试剂和C中相同,E中试剂所起的作用__,B装置除可检出某产物外,还可起到__作用。
(2)若进行上述实验时在F中得到10.0 g固体,则A中发生反应转移的电子数为__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列装置图的叙述正确的是

A.若X为粗铜,Y为硫酸铜,K接N,则此装置可以精炼铜
B.若X为铜,Y为浓硝酸,K接M,可以形成原电池,则铁为负极
C.若X为锌,则无论K接M还是N,铁都能被保护
D.若X为银,Y为FeCl3,K接N,则此装置可以在铁上镀银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,回答下列问题:

(1)甲池是_______装置,乙装置中电极A的名称是__________。
(2)甲装置中通入CH4的电极反应式为_______,乙装置中电极B(Ag)的电极反应式为______,丙装置中D极的产物是________(写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式);其物质的量为____________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com