
【题目】下图是一个电化学过程的示意图,回答下列问题:

(1)甲池是_______装置,乙装置中电极A的名称是__________。
(2)甲装置中通入CH4的电极反应式为_______,乙装置中电极B(Ag)的电极反应式为______,丙装置中D极的产物是________(写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式);其物质的量为____________mol。
【答案】原电池 阳极 CH4+10OH--8e-===CO32-+7H2O Ag++e-===Ag H2和NaOH 12 HCl 0.005
【解析】
该题综合考察了原电池和电解池的相关知识,甲池为燃料电池,甲烷在负极发生氧化反应,氧气在正极发生还原反应;与通入甲烷的一极相连接的为电解池的阴极,与通入氧气的一极相连接的为电解池的氧极,阴极发生还原反应,阳极发生氧化反应;乙池为电解硝酸银溶液,丙池为电解氯化钠溶液,据各自的反应进行分析计算。
(1)甲池能够自发进行氧化还原反应,属于原电池;其中通入CH4一极为电池负极,通入O2一极为电池正极,因此乙池中的电极A为阳极;
故答案是:原电池;阳极;
(2)甲池为燃料电池,CH4在负极发生氧化反应,通入CH4的电极反应式为CH4+10OH--8e-===CO32-+7H2O;乙池中B为阴极,发生还原反应,电极反应式为Ag++e-===Ag;丙池为电解池,且D极为阴极,电解液为NaCl溶液,则D极发生的电极反应为2H2O+2e-=H2+2OH-,产物为H2和NaOH;
故答案是:CH4+10OH--8e-===CO32-+7H2O;Ag++e-===Ag;H2和NaOH;
(3)丙池中发生的总反应为2NaCl+2H2O![]() 2NaOH+Cl2↑+ H2↑,标况下112mL气体对应的物质的量为0.005mol,根据总反应方程式可知,生成H2和Cl2各0.0025mol,则生成的c(OH-)=0.0025mol×2/0.5L=0.01mol/L,根据25 ℃时KW=c(H+)c(OH-)=10-14可知,c(H+)=10-12,对应的pH=12;要使丙池恢复电解前的状态,应向丙池中加入HCl; 根据Cl2+H2=2HCl可知,n(HCl)=2n(Cl2)=0.0025mol×2=0.005mol;
2NaOH+Cl2↑+ H2↑,标况下112mL气体对应的物质的量为0.005mol,根据总反应方程式可知,生成H2和Cl2各0.0025mol,则生成的c(OH-)=0.0025mol×2/0.5L=0.01mol/L,根据25 ℃时KW=c(H+)c(OH-)=10-14可知,c(H+)=10-12,对应的pH=12;要使丙池恢复电解前的状态,应向丙池中加入HCl; 根据Cl2+H2=2HCl可知,n(HCl)=2n(Cl2)=0.0025mol×2=0.005mol;
故答案是:12;HCl;0.005。


科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
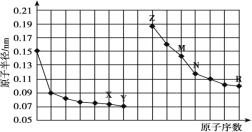
A.最高价氧化物对应水化物的碱性:Z<M
B.X、N 两种元素形成的化合物属于离子化合物
C.Y、R 两种元素气态氢化物的稳定性:Y>R
D.简单离子的半径:Z>M>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置如图所示。实验时在不锈钢舟内加入镁粉,通氮气15min,升温至1073K,加热半小时,冷却至室温,停止通氮气。下列说法正确的是( )
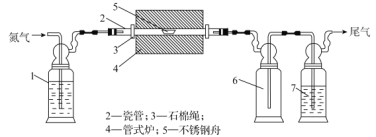
A.1中的试剂是饱和食盐水,便于观察气泡,调节气流速度
B.6的作用是缓冲加热后未反应的氮气,7的作用是防止空气中的水分进入装置
C.氮化镁是共价化合物,露置于空气中有刺激性气味的气体产生
D.实验中氮气是反应物,仅起到氧化镁粉的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存且加入(或通入)X试剂后发生反应的离子方程式对应正确的是
选项 | 离子组 | 试剂X | 离子方程式 |
A | Fe3+、Al3+、 | 过量的盐酸 |
|
B | 透明溶液中:Fe3+、 | 过量的铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
C | Na+、Ba2+、 | NaHSO4溶液 | H++ |
D | pH=1的溶液中:Mg2+、Fe2+、 | 双氧水 | 2Fe2++H2O2+2H+═2Fe3++2H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
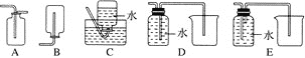
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu5Zn8等。
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于________(填“晶体”或“非晶体”)。
(2)基态铜原子有________个未成对电子;Cu2+的电子排布式为____________________;在CuSO4溶液中加入过量氨水,充分反应后加入少量乙醇,析出一种深蓝色晶体,该晶体的化学式为____________________,其所含化学键有____________________,乙醇分子中C原子的杂化轨道类型为________。
(3)铜能与类卤素(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2分子中含有σ键的数目为________。(SCN)2对应的酸有硫氰酸(H—S—C≡N)、异硫氰酸(H—N===C===S)两种。理论上前者沸点低于后者,其原因是______________________________________________________________________________________。

(4)ZnS的晶胞结构如图所示,在ZnS晶胞中,S2-的配位数为_______________。
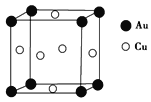
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为a nm,该金属互化物的密度为________ g·cm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列说法正确的是
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列说法正确的是
①用A表示的反应速率是0.4mol·L-1·min-1
②在2min末时,反应物B的反应速率是0.3mol·L-1·min-1
③在这2min内用C表示的平均速率为0.2mol·L-1·min-1
④在2min时,B、C、D的浓度比一定为3∶2∶1
⑤若D的起始浓度为0.1mol·L-1,则2 min时D的浓度为0.3mol·L-1
A.①②③B.②③⑤C.④⑤D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取4.1g烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需__________________ 、______________________。
(2)取10.00mL待测液,用___________________量取。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶,直到看到_________即可判断达到滴定终点。
(4)根据下列数据,计算待测烧碱溶液的浓度为:___________(结果保留四位有效数字)。(假设烧碱中不含有与酸反应的杂质)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)滴定过程,下列情况会使测定结果偏高的是____________________(填序号)。
①酸式滴定管用水洗后便装液体进行滴定;
②碱式滴定管水洗后,就用来量取待测液;
③锥形瓶用蒸馏水洗涤后,又用待测液润洗;
④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;
⑤盐酸在滴定时溅出锥形瓶外;
⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;
⑦滴定前,酸式滴定管有气泡,滴定后消失;
⑧记录起始体积时,仰视读数,终点时俯视。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com