
【题目】有关下列装置图的叙述正确的是

A.若X为粗铜,Y为硫酸铜,K接N,则此装置可以精炼铜
B.若X为铜,Y为浓硝酸,K接M,可以形成原电池,则铁为负极
C.若X为锌,则无论K接M还是N,铁都能被保护
D.若X为银,Y为FeCl3,K接N,则此装置可以在铁上镀银
【答案】C
【解析】
A、精炼铜,X是阳极,为粗铜放电,Y为硫酸铜溶液,阴极应为纯铜;
B、若K与M相接是原电池,X为铜,Y为浓硝酸,Cu失电子为负极;
C、若X为锌,则K接M为原电池,Fe作正极,K接N是电解池,铁作阴极;
D、Y为FeCl3,形成电解池时,阴极上铁离子得电子。
A、若K与N相接是电解池,X是阳极,为粗铜放电,Y为硫酸铜溶液,阴极应为纯铜,该装置才可以精炼铜,而阴极为铁,属于铁上镀铜,故A错误;
B、若K与M相接是原电池,X为铜,Y为浓硝酸,Fe在浓硝酸中钝化,则铁为正极,Cu失电子为负极,故B错误;
C、若X为锌,则K接M为原电池,Fe作正极被保护,K接N是电解池,铁作阴极被保护,所以若X为锌,则无论K接M还是N,铁都能被保护,故C正确;
D、若X为银,Y为FeCl3,形成电解池时,阴极上铁离子得电子,得不到银单质,所以不能在铁上镀银,故D错误;
故答案选C。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
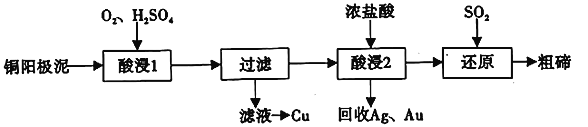
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
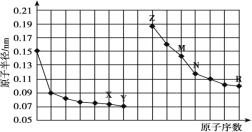
A.最高价氧化物对应水化物的碱性:Z<M
B.X、N 两种元素形成的化合物属于离子化合物
C.Y、R 两种元素气态氢化物的稳定性:Y>R
D.简单离子的半径:Z>M>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓(Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与铝是同主族元素,性质相似。
(1)铝在元素周期表中的位置是__________________。
(2)GaAs 是一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
①下列事实不能用元素周期律解释的是___________(填字母)。
a. 碱性:Ga (OH)3> Al (OH)3 b. 非金属性:As>Ga c. 酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释原因_________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式_________。
(3)工业上获取镓的方法之一是从闪锌矿冶锌后的残渣(主要含有 Zn、Pb、Fe、Ga 等元素)中提取,某科研单位设计下述流程提取镓,已知:Ga 在碱性溶液中以[Ga(OH)4]- 形式存在。
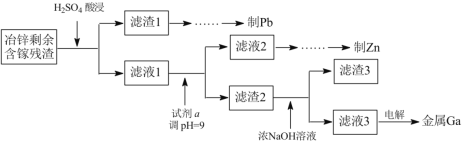
①试剂 a 是_______________。
②写出电解制镓时的阴极电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
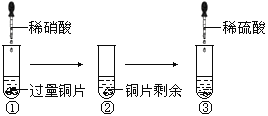
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇-空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图所示。下列有关叙述正确的是( )
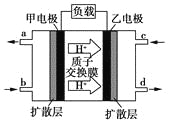
A.H+从正极区通过交换膜移向负极区
B.负极的电极反应式为:CH3OH(l)+H2O(l)-6e-===CO2(g)+6H+
C.d导出的是CO2
D.图中b、c加入的分别是O2、甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备氮化镁的装置如图所示。实验时在不锈钢舟内加入镁粉,通氮气15min,升温至1073K,加热半小时,冷却至室温,停止通氮气。下列说法正确的是( )
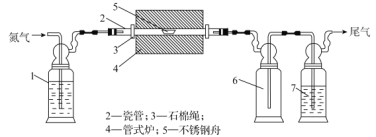
A.1中的试剂是饱和食盐水,便于观察气泡,调节气流速度
B.6的作用是缓冲加热后未反应的氮气,7的作用是防止空气中的水分进入装置
C.氮化镁是共价化合物,露置于空气中有刺激性气味的气体产生
D.实验中氮气是反应物,仅起到氧化镁粉的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存且加入(或通入)X试剂后发生反应的离子方程式对应正确的是
选项 | 离子组 | 试剂X | 离子方程式 |
A | Fe3+、Al3+、 | 过量的盐酸 |
|
B | 透明溶液中:Fe3+、 | 过量的铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
C | Na+、Ba2+、 | NaHSO4溶液 | H++ |
D | pH=1的溶液中:Mg2+、Fe2+、 | 双氧水 | 2Fe2++H2O2+2H+═2Fe3++2H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取4.1g烧碱样品。将样品配成250mL待测液,需要的主要玻璃仪器除烧杯、玻璃棒外还需__________________ 、______________________。
(2)取10.00mL待测液,用___________________量取。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶,直到看到_________即可判断达到滴定终点。
(4)根据下列数据,计算待测烧碱溶液的浓度为:___________(结果保留四位有效数字)。(假设烧碱中不含有与酸反应的杂质)
滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)滴定过程,下列情况会使测定结果偏高的是____________________(填序号)。
①酸式滴定管用水洗后便装液体进行滴定;
②碱式滴定管水洗后,就用来量取待测液;
③锥形瓶用蒸馏水洗涤后,又用待测液润洗;
④滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下;
⑤盐酸在滴定时溅出锥形瓶外;
⑥滴加盐酸,溶液颜色褪去但不足半分钟又恢复红色;
⑦滴定前,酸式滴定管有气泡,滴定后消失;
⑧记录起始体积时,仰视读数,终点时俯视。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com