
����Ŀ����һ������CO2����ͨ��2L��NaOH��Һ�У���������Һ����μ���ϡ������������������Һ���ȣ����������������ĵ�HCl���ʵ�����ϵ��ͼ��ʾ������������ܽ��HCl�Ļӷ���������˵������ȷ���ǣ� ��
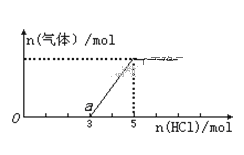
A.ͨ��CO2���������ڱ�״����Ϊ22.4 L
B.O��a�㷢����Ӧ�����ӷ���ʽ��H++OH��=H2O��CO32��+H+=HCO3��
C.O����Һ���������ʵĻ�ѧʽΪNaOH��Na2CO3
D.NaOH��Һ�����ʵ���Ũ��Ϊ2.5 molL��1
���𰸡�A
��������
A.��ͼ��֪��a�㿪ʼ�������壬������̼�����ʱ���ý����ĵ���������ʵ���Ϊ2mol�����ɷ���ʽHCO3��+H+= CO2 ��+H2O��֪������̼ҲΪ2mol�����ɵĶ�����̼�����ʵ������ڿ�ʼͨ��Ķ�����̼�����ʵ��������Ա���¶�����̼�����Ϊ44.8L���ʴ���
B. O��a�㷢����ӦΪ�����Ӻ����������ӷ�Ӧ����ˮ�������Ӻ�̼������ӷ�Ӧ����̼��������ӣ����ӷ���ʽH++OH��=H2O��CO32��+H+=HCO3��������ȷ��
C.̼���ƺ�����ķ�Ӧ�Ƿֲ����еģ�̼���ƺ����ᷴӦ����̼�����ƺ��Ȼ��ƣ�̼�����ƺ����ᷴӦ�����Ȼ��ƺ�ˮ�Ͷ�����̼�������̼���ƻ�̼�����Ʒ�Ӧ����1:1�ģ���ͼ���֪���ɶ�����̼���ĵ���������ʵ���С�ڷ�Ӧ��ʼ������������̼�����ĵ����ᣬ����Һ�е�����Ϊ�������ƺ�̼���ƣ�����ȷ��
D.����5mol�������ɵĶ�����̼��������ʱ��Һ������Ϊ�Ȼ��ƣ������������Ƶ����ʵ���Ϊ5mol�����������Ƶ�Ũ��Ϊ5mol/2L=2.5mol/L������ȷ��
��ѡA��


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2O2�ֽ������ܶ�������Ӱ�졣ʵ���� 70 ��ʱ��ͬ������H2O2Ũ����ʱ��ı仯��ͼ��ʾ������˵����ȷ����
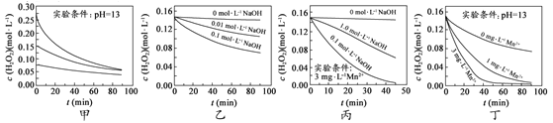
A.ͼ�ױ���������������ͬʱ��H2O2Ũ��ԽС����ֽ�����Խ��
B.ͼ�ұ���������������ͬʱ����ҺpHԽС��H2O2�ֽ�����Խ��
C.ͼ������������Mn 2+����ʱ����Һ����Խǿ��H2O2�ֽ�����Խ��
D.ͼ����ͼ��������������Һ�У�Mn2+��H2O2�ֽ����ʵ�Ӱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������ȵĹ��嵥�ʼ����Ի�ɫ��Ũ����Һ�У����ҷ�Ӧ�������������A��A�ڳ����²���������ã���������ͼ��ʾ�ı仯��

��д���������ʵĻ�ѧʽ��
��__________��B____________��C__________�� D____________��
��д�����ҷ�Ӧ�Ļ�ѧ����ʽ��__________________________��
�۵��ʱ�����Һ�ҷ�Ӧ��������B�����ӷ���ʽ��___________________��
��2����ͼ�Ǹ����ʵķ�Ӧ��ϵͼ����֪A��E���ǻ�ɫ��ĩ��F�д̼�����ζ����Ư���ԡ���ݴ˻ش��������⣺

д��ͼ�б�ŵĻ�ѧ����ʽ��
��_______________________��
��_______________________��
��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(���ʽṹ������)Ԫ�����ڱ��е�57��Ԫ���絽71��Ԫ������15��Ԫ��ͳ��Ϊ��ϵԪ�ء��ش���������:
(1)��(Ho)�������������Բ���,���̬ԭ�ӵ����Ų�ʽΪ[Xe]4f116s2,��(Ho)��___��δ�ɶԵ��ӡ�
(2)�Ʊ�ͭ��(YBa2Cu3O7-x)��һ�ָ��³�������(����Y��+3��,Cu��+2��+3��),�ò�������Ԫ����,�縺������Ԫ����______(��Ԫ�ط���),��YBa2Cu3O7-x������T �����г�����,��x=0.2ʱ,n(Cu3+)��n(Cu2+)=_____��
(3)�±��Ǽ�����ϵԪ�صĵ�����(��λ:kJ��mol-1)
��һ������ | �ڶ������� | ���������� | ���ĵ����� | |
Ce | 527 | 1047 | 1949 | 3547 |
La | 538 | 1067 | 1850 | 4819 |
Lu | 532 | 1340 | 2022 | 4370 |
Yb | 604 | 1174 | 2417 | 4203 |
�ݴ�,�ж��γ�+3�ۻ��������ȶ���Ԫ����____(��Ԫ�ط���)��
(4)Sm(��)�ĵ�����l,2-��������ɷ������·�Ӧ:Sm+ICH2CH2I��SmI2+CH2=CH2��ICH2CH2I��̼ԭ���ӻ��������Ϊ____,1 mol CH2=CH2�к��е�������ĿΪ_______;������l,2-��������ΪҺ�������Ϊ����,����Ҫԭ����_____��
(5)�����ƿ��п���ȡϡ��Ԫ����(Y),ij���ƿ�Ľṹ��ͼ��
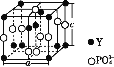
�����ƿ�Ļ�ѧʽΪ____,��PO43-��Ϊ�ȵ��������������____(д���������ӵĻ�ѧʽ)����֪��������a=0.69 nm,c=0.60 nm,�����ӵ�����ΪNA,�����ܶ�Ϊ____g��cm-3(�г�����ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��Ϊ��̽��һ����������X(��������Ԫ��)����ɺ����ʣ���Ʋ��������ʵ�飺
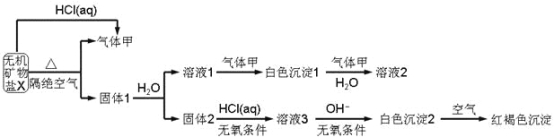
��ȡ10.80gX�ڶ��������м�������ȫ�ֽ⣬�õ�6.40g����1.��ش��������⣺
��1��������ɫ����1�н���Ԫ�ص�ԭ�ӽṹʾ��ͼ_______��д������ĵ���ʽ_______��
��2��X�Ļ�ѧʽ��______���ڶ��������м���X����ȫ�ֽ�Ļ�ѧ��Ӧ����ʽΪ_______��
��3����ɫ����2�ڿ����б�ɺ��ɫ������ԭ����_______(�û�ѧ��Ӧ����ʽ��ʾ)��
��4��һ�������£�����������1�е�ij�ֳɷֿ��ܷ���������ԭ��Ӧ��д��һ�����ܵĻ�ѧ��Ӧ����ʽ_______�������ʵ�鷽����֤�÷�Ӧ�IJ���_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ͺϽ��ǿ�ȸ���֧��"��"�����Ǹֽ��������Ԫ���⣬������Mn(��)��Ti(��)��(��)��(��)�ȺϽ�Ԫ�أ������й�˵����ȷ���ǣ� ��
A. Feλ��Ԫ�����ڱ��ĵ������ڣ���VIIIB��
B. 46TiO�� 48TiO��50TiO��Ϊͬλ��
C. Mn 2O7������������
D. ![]() ԭ�Ӻ����и�51�����ӣ������� 41������
ԭ�Ӻ����и�51�����ӣ������� 41������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬TΪ������ʹ����㷺�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ������

��1������A�Ļ�ѧʽΪ ________��
��2��H�ڳ�ʪ�����б��M��ʵ��������______________________________________����ѧ����ʽΪ___________________________________________��
��3��A��ˮ��Ӧ����B��C�����ӷ���ʽΪ___________________________________���ɴ˷�Ӧ��֪A����Ϊ_________����;��
��4������ٵ����ӷ���ʽ_______________________________________����д�����鲽��ٵõ�����Һ����Ҫ�����ӣ���H+�⣩����Ҫ���Լ���_____________��____________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�������ȷ�Ӧʵ�顣����˵������ȷ������ ��

A���÷�Ӧ�ķ���ʽ��2Al+Fe2O3 ![]() 2Fe+Al2O3
2Fe+Al2O3
B���÷�Ӧ�������£�����ǿ��
C���������ȷ�Ӧԭ��������ұ��ijЩ����
D������Ӧ��ת��3 mol���ӣ������������������ʵ�����1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС������NaI��Һ��ͨ������Cl2�õ������Һ�������ú����Һ��ȡNaI���壬ʵ���������£�

��֪��Ӧ����2I��+2Cu2++![]() +H2O
+H2O![]() 2CuI��+
2CuI��+![]() +2H+��
+2H+��
�ش��������⣺
��1������ʵ������Ҫ�IJ�����������ͨ©�����ձ���_____________��
��2����Ӧ����CuI����������ԭ����ֻ��NO2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________������95.5 g CuI���뷴Ӧ������Ҫ�����______________L��O2���ܽ����ɵ�NO2��ˮ����ȫת��Ϊ���ᡣ
��3��������B�к�����Ԫ�أ���ԭ������һ��Ԫ��ԭ�ӵ����ʵ���֮��Ϊ3��8������B�Ļ�ѧʽΪ_____________��
��4����Ӧ�������ɺ�ɫ�������ɫ���壬��ɫ������׳�Ϊ��������������Ӧ���Ļ�ѧ����ʽΪ______��
��5����������Cl2ͨ�뺬12 g NaI����Һ�У�һ��ʱ������Һ���ɵõ����������Ϊ_________g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com