
【题目】下列离子方程式正确的是
A.碳酸钙与醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
C.碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-=H2O+CO2↑
D.将氯气通入KBr溶液中:Cl2+2Br-=2Cl-+Br2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在容积不变的密闭容器中加入P、Q进行反应P(g)+2Q(g)![]() 3R(g)+S(l),说明该反应达到平衡的是
3R(g)+S(l),说明该反应达到平衡的是
A.反应容器中气体的平均摩尔质量不再改变
B.反应容器中P、Q、R、S四者共存
C.2v正(Q)=3 v逆(R)
D.反应容器中压强不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是

A. ①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图象,曲线a是使用催化剂的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
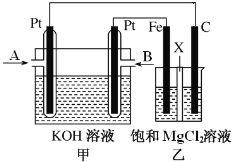
A.甲中A处通入CH4,电极反应式为CH4+10OH8e![]() +7H2O
+7H2O
B.乙中电解MgCl2溶液的总反应为2Cl+2H2O![]() Cl2↑+H2↑+2OH
Cl2↑+H2↑+2OH
C.理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D.甲、乙中电解质溶液的pH都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、Mg2+、Fe2+、H+、HCO3-、OH-、Cl-、NO3-、I-中的若干种,向该溶液中加入铝粉后,溶液中有AlO2-生成,则原溶液中能大最共存的离子最多有
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的密闭容器中充入2 mol SO2和1 mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
A. 充入2 mol SO3后,SO2的物质的量增大
B. 第一次反应达到平衡时共放出热量176.4 kJ
C. 充入2 mol SO3达到新平衡时,容器内的压强为1.4p
D. 降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
A.减小压强 B.降低温度
C.增大O2浓度 D.使用合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com