
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:

(1)实验室制备Cl2的离子方程式是_____________________________,应选用上图A、E装置中的______(填序号)制Cl2,反应中浓盐酸所表现出的性质是_________________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是___________________________________。
(3)装置C的作用是____________________________________。
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:

①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是_____________________。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是(用相应的离子方程式作答)____________
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,原因是_______________________________________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++2H2O +Cl2↑ E 酸性和还原性 溶液由无色变为红色 吸收多余的氯气和二氧化硫 使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合 2SO2+Cl2 +2H2O=4H++SO42-+2Cl- SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性
Mn2++2H2O +Cl2↑ E 酸性和还原性 溶液由无色变为红色 吸收多余的氯气和二氧化硫 使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合 2SO2+Cl2 +2H2O=4H++SO42-+2Cl- SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性
【解析】(1)实验室利用二氧化锰与浓盐酸在加热条件下制备氯气,反应生成氯化锰、氯气与水,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑,反应中氯元素化合价升高,同时还有氯化锰生成,则反应中浓盐酸所表现出的性质是酸性和还原性;反应需要加热,所以应该用E制备氯气,用A制备二氧化硫;(2)B装置中二氧化硫和有色物质化合生成不稳定无色物质,使品红溶液红色褪去,再加热B中褪色后溶液时,又恢复红色,因此B试管中的现象是溶液由无色变为红色;(3)二氧化硫、氯气均有毒,直接排放会污染空气,装置C的作用是吸收多余的SO2和Cl2;(4)①浓硫酸和二氧化硫、氯气不反应,但氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合,即通过盛有浓硫酸装置的目的是使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合;②氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,离子反应方程式为2SO2+Cl2+2H2O=4H++SO42-+2Cl-;③通气一段时间后,品红溶液颜色随时间推移变得越来越浅,说明有漂白性;这说明SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性。
Mn2++2H2O+Cl2↑,反应中氯元素化合价升高,同时还有氯化锰生成,则反应中浓盐酸所表现出的性质是酸性和还原性;反应需要加热,所以应该用E制备氯气,用A制备二氧化硫;(2)B装置中二氧化硫和有色物质化合生成不稳定无色物质,使品红溶液红色褪去,再加热B中褪色后溶液时,又恢复红色,因此B试管中的现象是溶液由无色变为红色;(3)二氧化硫、氯气均有毒,直接排放会污染空气,装置C的作用是吸收多余的SO2和Cl2;(4)①浓硫酸和二氧化硫、氯气不反应,但氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者按一定比列混合,即通过盛有浓硫酸装置的目的是使两种气体充分混合;通过观察气泡的速度控制气体流量,使二者按一定比列混合;②氯气有强氧化性,二氧化硫有还原性,二者能按1:1发生氧化还原反应而使气体失去漂白性,离子反应方程式为2SO2+Cl2+2H2O=4H++SO42-+2Cl-;③通气一段时间后,品红溶液颜色随时间推移变得越来越浅,说明有漂白性;这说明SO2和Cl2的进气速度不相等,混合发生反应后其中一种气体有剩余,仍具有漂白性。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
【题目】氮族元素和硼族元素在生产生活中有很重要的地位.
(1)写出硼族元素Ga的基态原子核外电子排布式
(2)NF3的分子构型为 , NO3﹣的空间构型为 , 1mol NO3﹣中含有的σ键的数目为: .
(3)氮化硼的立方结晶的变体被认为是已知的最硬的物质.BN的晶体结构与金刚石相似,其中B原子的杂化方式为
(4)元素第一电离能的大小:As(填“<”“>”或“=”)Ga,原因是 .
(5)相同条件下,在水中的溶解度:NH3(填“<”“>”或“=”)PH3 , 原因是 .
(6)已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm.则砷化镓的化学式为 , 晶胞中As原子和它最近的Ga原子之间的距离为pm(用含c的式子表示),砷化镓的密度为gcm﹣3(设NA为阿伏伽德罗常数的值,用含c、NA的式子表示,原子量:Ga﹣70,As﹣75). 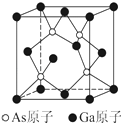
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合题。
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是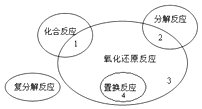
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3
D.CH4+2O2CO2+2H2O
(2)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O
①其中还原剂 , 还原产物是 .
②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为 , 转移电子的物质的量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯是一种香料,其结构简式如图.下列有关肉桂酸异戊酯的叙述正确的是( ) 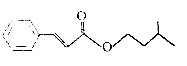
A.不能使溴的四氯化碳溶液褪色
B.能与新制的Cu(OH)2共热生成红色沉淀
C.能与FeCl3溶液反应显紫色
D.能与热的浓硝酸和浓硫酸混合液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运场馆 “水立方” 顶部和外部使用了一种新型膜材料,它与制作塑料袋的材料类型相同,都属于
A. 光导纤维B. 有机合成材料C. 金属材料D. 玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是造纸、玻璃、纺织、制革等行业的重要原料.
(1)路布兰法制备纯碱:①食盐与硫酸反应生成硫酸钠;②将硫酸钠、石灰石和足量煤混合,高温下共熔制得碳酸钠,反应有硫化钙生成.第②步反应的化学方程式为 .
(2)①原盐水中含少量Mg2和Ca2 , 结合生产实际,精制盐水需要的试剂时、 . (填化学式)
②步骤 II保持在30﹣35℃进行,反应的化学方程式为 , 该反应能发生的原因是 . 该工艺中循环利用的物质是 .
③索尔维制纯碱不需要用到的一种设备是 (填正确答案标号).
A.吸氨塔 B.蒸氨塔 C.碳酸化塔 D.沸腾炉 E.石灰窑
④该工艺中食盐利用率大约只有70%,食盐损失的主要原因是 . 我国科学家侯德榜将合成氨工业得到的NH3和CO2引入纯碱的生产,向上述工艺的“母液”中通入NH3并加入食盐固体,降温结晶得到副产品(填化学式),剩余母液返回“吸氨”步骤,大大提高了食盐的利用率.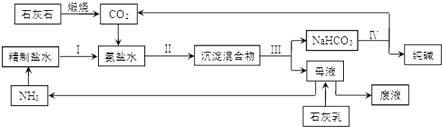
(3)纯碱产品中可能含有碳酸氢钠.用热重分析的方法测定纯碱中碳酸氢钠的质量分数为ω(NAHCO3)=(列出算式,所需数据用字母表示,并说明各字母的含义).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E、F、G在元素周期表中的位置如图1所示,回答下列问题: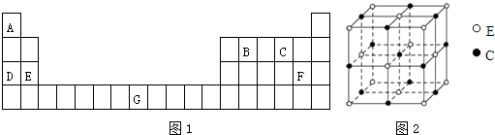
(1)G的基态原子核外电子排布式为 . 原子的第一电离能:DE(填“>”或“<”).
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l﹣l>l﹣b>b﹣b(l为孤对电子对,b为键合电子对),则关于A2C中的A﹣C﹣A键角可得出的结论是 .
A.180°
B.接近120°,但小于120°
C.接近120°,但大于120°
D.接近109°28′,但小于109°28′
(3)化合物G(BC)5的熔点为﹣20℃,沸点为103℃,其固体属于晶体,该物质中存在的化学键类型有 , 它在空气中燃烧生成红棕色氧化物,反应的化学方程式为 .
(4)化合物BCF2的立体构型为 , 其中B原子的杂化轨道类型是 , 写出两个与BCF2具有相同空间构型的含氧酸根离子 .
(5)化合物EC的晶胞结构如图2所示,晶胞参数a=0.424nm.每个晶胞中含有个E2+ , 列式计算EC晶体的密度 gcm﹣3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列说法正确的是( ) 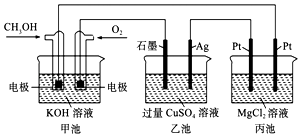
A.甲池中阳离子向通入CH3OH一方的电极区域内移动
B.甲池通入CH3OH的电极反应式为CH3OH﹣6e﹣+2H2O═CO32﹣+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2 , 此时丙池中理论上产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铁溶液与碘化钾溶液反应:Fe3++2I-===Fe2++I2
B. 硫酸溶液与氢氧化钡溶液反应:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
C. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+===Ca2++H2O+CO2↑
D. 氯化铝溶液与过量氨水反应:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com