
��������ĵ���ƽ�ⳣ�����±���
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ����25�棩 | K=1.77��10-4 | K=4.9��10-10 | K1=4.2��10-7 K2=5.6��10-11 |
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���и���Һ�У��������ʵ���Ũ�ȹ�ϵ��ȷ����( )
| A�������£���pH=2�������pH=12�İ�ˮ�������Ϻ�c(NH4��)>c(Cl��)> c(OH��)>c(H��) |
| B��0.1 mol��L��1 Na2CO3��Һ��c(Na+)��2c(HCO3-)��2c(CO32¯)��2c(H2CO3) |
| C��0.1 mol��L��1 NH4Cl��Һ��c(NH4+)��c( Cl��) |
| D�����������Һ�м����������ᣬ�õ������Ի����Һ�� c(Na��)>c(CH3COO��)>c(H��)>c(OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ��ˮ��Һ��c(H+)��c(OH��)�ı仯��ϵ��ͼ������a c��ʾ�������жϴ������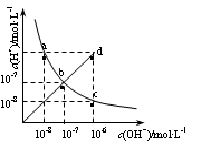
| A��a c�����ϵ�����һ�㶼��c(H+)��c(OH��)��10-14 |
| B��b d�߶�������һ���Ӧ����Һ�������� |
| C��d���Ӧ��Һ���¶ȸ���25�棬pH��7 |
| D��CH3COONa��Һ������λ��c�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij�¶��£������pH����ͬ�������AlCl3��Һ��ˮϡ��ʱ��pH�仯������ͼ�������й�˵����ȷ����(����)
| A��Al(OH)3�ĵ��뷽��ʽΪ��Al(OH)3��Al3+��3OH�� |
| B��a����Һ���У� c(H��)��c(Al3+)��c(OH��) ��3c(Cl��) |
| C������X��ʾ����ϡ���̵�pH�仯 |
| D��b��c����Һc(OH��)��c(Cl��)����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ��ijŨ�ȵ��Ȼ����Һ��pH��4�����������в���ȷ����(����)
| A����Һ�е�c(OH��)��1��10��10 mol��L��1 |
| B����Һ�е�c(Cl��)>c(NH4+)>c(H��)>c(OH��) |
| C����Һ�е�c(H��)��c(NH4+)��c(Cl��)��c(OH��) |
| D����Һ�е�c(NH3��H2O)��c(NH4+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25 ��ʱ��5�����ε��ܶȻ�����(Ksp)�ֱ��ǣ�
| AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 1.8��10��10 | 1.4��10��5 | 6.3��10��50 | 7.7��10��13 | 8.51��10��16 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���25 mL 0.1 mol/L NaOH��Һ����μ���0.2 mol/L CH3COOH��Һ��pH��μ�CH3COOH��Һ����Ĺ�ϵ������ͼ��ʾ������������Һ���ʱ������仯�������й�����Ũ�ȹ�ϵ��˵��������ǣ�������
A����A��B����һ�㣬��Һ��һ������c��Na������c��H������c��CH3COO������c��OH����
B����B�㣺a��12.5������c��Na������c��CH3COO������c��OH������c��H����
C����C�㣺c��Na������c��CH3COO������c��H������c��OH����
D����D�㣺c��CH3COO������c��CH3COOH����0.1 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ѪҺ���������ƽ�⣺CO2��H2O H2CO3
H2CO3 HCO3-ʹ������ѪҺpH������7.35��7.45֮�䣬����ͻᷢ�����ж�����ж�����pH��c��HCO3-����c��H2CO3���仯��ϵ�����ʾ��������˵���У���ȷ���ǣ�������
HCO3-ʹ������ѪҺpH������7.35��7.45֮�䣬����ͻᷢ�����ж�����ж�����pH��c��HCO3-����c��H2CO3���仯��ϵ�����ʾ��������˵���У���ȷ���ǣ�������
| c��HCO3-��?c��H2CO3�� | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������a mol��L��1ϡ��ˮ��b mol��L��1ϡ����������ϣ��Ի�Ϻ���Һ�ж�һ����ȷ����(����)
| A����a��b����c(NH4+)��c(Cl��) |
| B����a��b����c(NH4+)��c(Cl��) |
| C����a��b����c(OH��)��c(H��) |
| D����a��b����c(OH��)��c(H��) |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com