
【题目】乙烯是重要的化工原料,以乙烯为原料生产部分化工产品的流程如下(部分反应条件已略去):
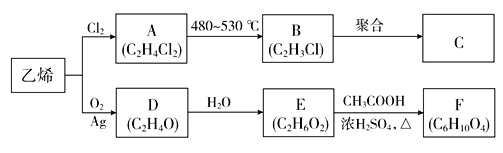
已知:E分子中含有两个羟基,且不连在同一个碳原子上。
请回答下列问题:
(1)由乙烯生成A的反应类型为________。
(2)C是一种常见的塑料,其化学名称为_________。
(3)D是环状化合物,其结构简式为__________________。
(4)写出下列反应的化学方程式:
①A→B:_____________________
②E→F:_____________________
(5)已知烯烃能发生如下反应:
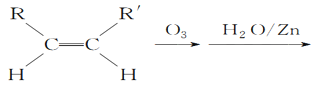 RCHO+R′CHO
RCHO+R′CHO
请写出下列反应产物的结构简式
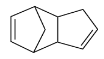
![]()
![]() ____________。
____________。
【答案】加成反应 聚氯乙烯 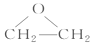 Cl—CH2—CH2—Cl
Cl—CH2—CH2—Cl![]() Cl—CH=CH2+HCl HOCH2CH2OH+2CH3COOH
Cl—CH=CH2+HCl HOCH2CH2OH+2CH3COOH![]() CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O 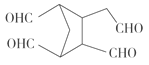
【解析】
乙烯与氯气发生加成反应生成1,2-二氯乙烷,A是Cl—CH2—CH2—Cl;A在一定条件下发生消去反应生成氯乙烯,B是Cl—CH=CH2;氯乙烯发生加聚反应生成聚氯乙烯,C是![]() ;D是分子式为C2H4O的环状化合物,D是
;D是分子式为C2H4O的环状化合物,D是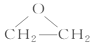 ;E分子中含有两个羟基,且不连在同一个碳原子上,E是HOCH2CH2OH;HOCH2CH2OH与乙酸发生酯化反应生成F,F是CH3COOCH2CH2OOCCH3。
;E分子中含有两个羟基,且不连在同一个碳原子上,E是HOCH2CH2OH;HOCH2CH2OH与乙酸发生酯化反应生成F,F是CH3COOCH2CH2OOCCH3。
根据以上分析,(1)乙烯生成与氯气反应生成Cl—CH2—CH2—Cl,反应类型为加成反应。
(2)氯乙烯发生加聚反应生成![]() ,
,![]() 的化学名称为聚氯乙烯。
的化学名称为聚氯乙烯。
(3)D是分子式为C2H4O的环状化合物,D是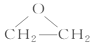 。
。
(4)①Cl—CH2—CH2—Cl在一定条件下发生消去反应生成Cl—CH=CH2,反应方程式是Cl—CH2—CH2—Cl![]() Cl—CH=CH2+HCl;
Cl—CH=CH2+HCl;
②HOCH2CH2OH与乙酸发生酯化反应生成CH3COOCH2CH2OOCCH3的方程式是HOCH2CH2OH+2CH3COOH![]() CH3COOCH2CH2OOCCH3+2H2O;
CH3COOCH2CH2OOCCH3+2H2O;
(5)根据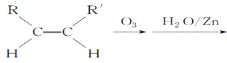 RCHO+R′CHO可知,双键碳原子被氧化为醛基, 所以
RCHO+R′CHO可知,双键碳原子被氧化为醛基, 所以![]()
![]()
![]()
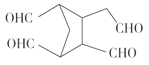 。
。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,依次进行如下实验:
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液;
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③继续滴加amL0.1mol/L稀盐酸,至溶液的pH=7。
下列说法正确的是
A.①中溶液的pH=1
B.②中反应后溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.③中,a=20
D.③中,反应后溶液:c(Na+)=c(CH3COO-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是( )
A.Zn2+基态核外电子排布式为[Ar]3d10
B.1molHCHO分子中含有σ键的数目为3mol
C.HOCH2CN分子中碳原子轨道的杂化类型是sp3
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为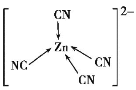
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择______(填字母)。
a.碳棒 b.锌板 c.铜板
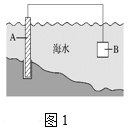
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
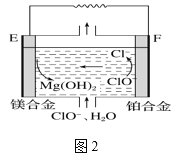
①E为该燃料电池的______(填“正”或“负”)极。F电极上的电极反应式为_________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学方程式解释其原因______________________。
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
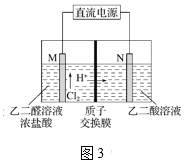
①N电极上的电极反应式为_____________。
②若有2 molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,易溶于酸,难溶于水、乙醇等溶剂。某实验小组拟选用如图装置(部分固定装置略)制备过氧化钙。
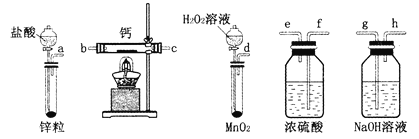
(1)请选择必要的装置,按气流方向连接顺序为____________(填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:
①检验装置的气密性后,装入药品;
②打开分液漏斗活塞,通入一段时间气体,加热药品;
③反应结束后,________(填操作);
④拆除装置,取出产物。
(3)一小组同学利用CaCl2在碱性条件下与H2O2反应制得。制备CaO2的实验方案和装置示意图:

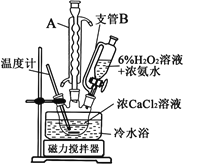
①三颈烧瓶中发生的主要反应的化学方程式为___________________________________;
②支管B的作用是_________________________;
③步骤③中洗涤CaO2·8H2O的液体X的最佳选择是____________;
A.无水乙醇B.浓盐酸C.水D.CaCl2溶液
④该反应常用冰水浴控制温度在℃左右,其可能的原因该反应是放热反应,温度低有利于提高CaO2·8H2O产率;________________________________________。
(4)测定产品中CaO2含量的实验步骤:
步骤一:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴________(作指示剂)。
步骤三:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液的体积为VmL。
CaO2的质量分数为________(用字母表示)。(已知:I2+2S2O32-===2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g)△H
(g)+H2(g)△H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入amol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>”“<”或“=”),乙苯的转化率将________(填“增大”“减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图
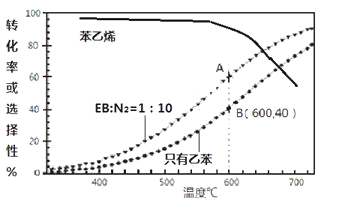
①A、B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实____________。
③控制反应温度为600℃的理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物分子M只含有C、H、O三种元素,其球棍模型如图所示。下列有关M的说法正确的是( )
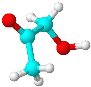
A.M中只含有一种官能团
B.M与浓硫酸共热能发生消去反应
C.M能与H2在一定条件下发生加成反应
D.M和乙酸互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】借助于李比希法、现代科学仪器及化学实验可以测定有机物的组成和结构。实验兴趣小组用如下图所示的装置测定某有机物X(含元素C、H、O中的两种或三种)的组成。实验测得样品X消耗的质量为1.50g,高氯酸镁质量增加0.90g,碱石棉质量增加2.20g。
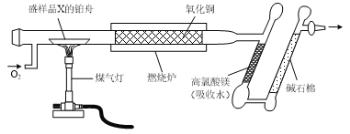
(1)由实验数据分析计算可得X的实验式为_____。
(2)若红外光谱测得X中含有“C=O”和“C-O-C”的结构,质谱法测得X的相对分子质量是60,则X的名称为_______。
(3)若实验测得相同状况下,X蒸汽的密度是H2密度的45倍(已知相同状况下,气体的密度比等于摩尔质量之比),X能发生银镜反应,1mol X最多能与2mol Na发生反应。则X的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)含碳物质的价值型转化,有利于“减碳”和可持续性发展,有着重要的研究价值。请回答下列问题:
(1)已知CO分子中化学键为C≡O。相关的化学键键能数据如下:
化学键 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡转化率的措施有_______________(填标号)。
a.增大压强 b.降低温度
c.提高原料气中H2O的比例 d.使用高效催化剂
(2)用惰性电极电解KHCO3溶液,可将空气中的CO2转化为甲酸根(HCOO),然后进一步可以制得重要有机化工原料甲酸。CO2发生反应的电极反应式为________________,若电解过程中转移1 mol电子,阳极生成气体的体积(标准状况)为_________L。
(3)乙苯催化脱氢制取苯乙烯的反应为:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反应历程如下:
(g)+CO(g)+H2O(g),其反应历程如下:
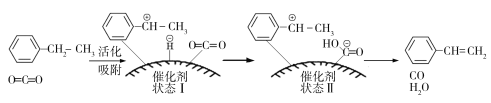
①由原料到状态Ⅰ____________能量(填“放出”或“吸收”)。
②一定温度下,向恒容密闭容器中充入2 mol乙苯和2 mol CO2,起始压强为p0,平衡时容器内气体总物质的量为5 mol,乙苯的转化率为_______,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_______。[气体分压(p分)=气体总压(p总)×气体体积分数]
③乙苯平衡转化率与p(CO2)的关系如下图所示,请解释乙苯平衡转化率随着p(CO2)变化而变化的原因________________________________________________。
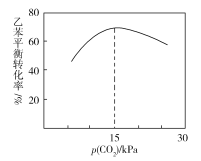
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com