
ЁОЬтФПЁПЖўбѕЛЏТШЃЈClO2ЃЉЙуЗКгІгУгкжННЌЦЏАзЁЂЩБОњЯћЖОКЭЫЎОЛЛЏДІРэЕШСьгђЁЃЙЄвЕЩЯРћгУМзДМЛЙдNaClO3ЕФЗНЗЈжЦБИClO2ЃЌЙЄвеСїГЬШчЯТЃК
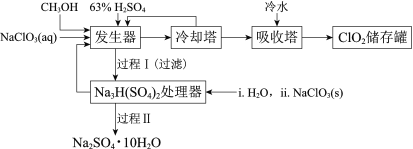
вбжЊЃКaЃЎЗЂЩњЦїжажЦБИClO2ЕФЗДгІЃК12NaClO3+8H2SO4+3CH3OH= 12ClO2Ёќ+3HCOOH+4Na3H(SO4)2Ё§+9H2O
bЃЎЯрЙиЮяжЪЕФШлЗаЕуЃК
ЮяжЪ | CH3OH | HCOOH | ClO2 |
ШлЕу/Ёц | Ѓ97 | 9 | Ѓ59 |
ЗаЕу/Ёц | 65 | 101 | 11 |
(1)ClO2ПЩгУгкжННЌЦЏАзЁЂЩБОњЯћЖОЪЧвђЦфОпга______адЁЃ
(2)РфШДЫўгУгкЗжРыClO2ВЂЛиЪеCH3OHЃЌгІПижЦЕФзюМбЮТЖШЮЊ______ЃЈЬюзжФИЃЉЁЃ
AЃЎ0~10Ёц BЃЎ20~30Ёц CЃЎ60~70Ёц
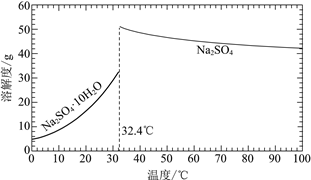
(3)ОЙ§ГЬЂёКЭЙ§ГЬЂђПЩвдЛёЕУУЂЯѕЃЈNa2SO4ЁЄ10H2OЃЉВЂЪЙВПЗждСЯбЛЗРћгУЁЃ
вбжЊЃКNa2SO4ЁЄ10H2OКЭNa2SO4ЕФШмНтЖШЧњЯпШчЯТЭМЃК
ЂйNa3H(SO4)2ДІРэЦїжаЛёЕУУЂЯѕЪБашМгШыNaClO3ЙЬЬхЃЌДгУЂЯѕШмНтЦНКтЕФНЧЖШНтЪЭЦфдвђЃК______ЁЃ
ЂкНсКЯNa2SO4ЁЄ10H2OКЭNa2SO4ЕФШмНтЖШЧњЯпЃЌЙ§ГЬЂђЕФВйзїЪЧЃКдк32.4ЁцКуЮТеєЗЂЃЌ______ЁЃ
ЂлNa3H(SO4)2ДІРэЦїЕФТЫвКжаПЩвдбЛЗРћгУЕФдСЯЪЧNaClO3КЭ______ЁЃ
ЁОД№АИЁПбѕЛЏ B ![]() ЃЌМгШыNaClO3ЃЌЪЙФЦРызгХЈЖШдіДѓЃЌЦНКтФцЯђвЦЖЏЃЌгаРћгкNa2SO4ЁЄ10H2OЕФЮіГі РфШДНсОЇЃЌЙ§ТЫЃЌЯДЕгЃЌИЩдя H2SO4
ЃЌМгШыNaClO3ЃЌЪЙФЦРызгХЈЖШдіДѓЃЌЦНКтФцЯђвЦЖЏЃЌгаРћгкNa2SO4ЁЄ10H2OЕФЮіГі РфШДНсОЇЃЌЙ§ТЫЃЌЯДЕгЃЌИЩдя H2SO4
ЁОНтЮіЁП
гЩСїГЬПЩжЊЃЌЗЂЩњЦїжажЦБИClO2, РфШДЫўгУгкЗжРыClO2ВЂЛиЪеCH3OHЃЌдкЮќЪеЫўжагУРфЫЎРфФ§ClO2ЃЌзюКѓдйДЂДцЃЛЗЂЩњЦїжаЩњГЩЕФNa3H(SO4)2НјШыNa3H(SO4)2ДІРэЦїЃЌгУH2O2КЭNaClO3ДІРэЕУЕНNa2SO4ЁЄ10H2OЁЃ
ЃЈ1ЃЉClO2ПЩгУгкжННЌЦЏАзЁЂЩБОњЯћЖОЪЧвђЦфОпгабѕЛЏадЃЌЙЪД№АИЮЊЃКбѕЛЏЃЛ
ЃЈ2ЃЉРфШДЫўгУгкЗжРыClO2ВЂЛиЪеCH3OHЃЌИљОнБэИёжаЯрЙиЮяжЪЕФШмНтЖШЃЌПижЦЕФЮТЖШгІИУЪЙCH3OHвКЛЏЃЌЕЋЪЧClO2ВЛФмвКЛЏЃЌжЛгаBЯюКЯЪЪЃЌД№АИбЁBЃЛ
ЃЈ3ЃЉЂйдкДІРэЦїжаЛсЗЂЩњЗДгІЃК![]() ЃЌМгШыNaClO3ЃЌЪЙФЦРызгХЈЖШдіДѓЃЌЦНКтФцЯђвЦЖЏЃЌгаРћгкNa2SO4ЁЄ10H2OЕФЮіГіЃЌЙЪД№АИЮЊЃК
ЃЌМгШыNaClO3ЃЌЪЙФЦРызгХЈЖШдіДѓЃЌЦНКтФцЯђвЦЖЏЃЌгаРћгкNa2SO4ЁЄ10H2OЕФЮіГіЃЌЙЪД№АИЮЊЃК![]() ЃЌМгШыNaClO3ЃЌЪЙФЦРызгХЈЖШдіДѓЃЌЦНКтФцЯђвЦЖЏЃЌгаРћгкNa2SO4ЁЄ10H2OЕФЮіГіЃЛ
ЃЌМгШыNaClO3ЃЌЪЙФЦРызгХЈЖШдіДѓЃЌЦНКтФцЯђвЦЖЏЃЌгаРћгкNa2SO4ЁЄ10H2OЕФЮіГіЃЛ
ЂкЙ§ГЬЂђЕФВйзїЮЊдк32.4ЁцКуЮТеєЗЂКѓЃЌдйРфШДНсОЇЃЌЙ§ТЫЃЌЯДЕгЃЌИЩдяЃЌЙЪД№АИЮЊЃКРфШДНсОЇЃЌЙ§ТЫЃЌЯДЕгЃЌИЩдяЃЛ
ЂлNa3H(SO4)2ДІРэЦїЕФТЫвКжаПЩвдбЛЗРћгУЕФдСЯЮЊNaClO3КЭH2SO4,ЙЪД№АИЮЊЃКH2SO4ЁЃ


 ИпжаБиЫЂЬтЯЕСаД№АИ
ИпжаБиЫЂЬтЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщЕФЗДгІдРэгУРызгЗНГЬЪНБэЪОе§ШЗЕФЪЧЃЈ ЃЉ
A. ЪвЮТЯТЃЌВтЕФТШЛЏяЇШмвКpH<7ЃЌжЄУївЛЫЎКЯАБЕФЪЧШѕМюЃКNH4ЃЋЃЋ2H2O=NH3ЁЄH2OЃЋH3OЃЋ
B. гУЧтбѕЛЏФЦШмвКГ§ШЅУОЗлжаЕФдгжЪТСЃК2AlЃЋ2OHЃЃЋ2H2O=2AlO2ЃЃЋ3H2Ёќ
C. гУЬМЫсЧтФЦШмвКМьбщЫЎбюЫсжаЕФєШЛљЃК
 +2HCO3-Ёњ
+2HCO3-Ёњ +2H2O+2CO2Ёќ
+2H2O+2CO2Ёќ
D. гУИпУЬЫсМиБъзМШмвКЕЮЖЈВнЫсЃК2MnO4ЃЃЋ16HЃЋЃЋ5C2O42Ѓ=2Mn2ЃЋЃЋ10CO2ЁќЃЋ8H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛИіУмБеШнЦїжаЗЂЩњЗДгІЃК2SO2(g)+O2(g)![]() 2SO3(g)ЁЃвбжЊЗДгІЙ§ГЬжаЕФФГвЛЪБМфSO2ЁЂO2КЭSO3ЕФХЈЖШЗжБ№ЮЊЃК0.2mol/LЁЂ0.1mol/LКЭ0.2mol/LЁЃЕБЗДгІДяЕНЦНКтЪБПЩФмДцдкЕФЪ§Оне§ШЗЕФЪЧ
2SO3(g)ЁЃвбжЊЗДгІЙ§ГЬжаЕФФГвЛЪБМфSO2ЁЂO2КЭSO3ЕФХЈЖШЗжБ№ЮЊЃК0.2mol/LЁЂ0.1mol/LКЭ0.2mol/LЁЃЕБЗДгІДяЕНЦНКтЪБПЩФмДцдкЕФЪ§Оне§ШЗЕФЪЧ
A.c(O2)ЃН0.2mol/LB.c(SO2)ЃН0.25mol/L
C.c(SO3)ЃН0.4mol/LD.c(SO2)ЃНc(SO3)ЃН0.15mol/L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯђФГХЈЖШЕФЖўдЊШѕЫсH2C2O4ШмвКжаж№ЕЮМгШыNaOHШмвКЃЌpCгыШмвКpHЕФБфЛЏЙиЯЕШчЭМЫљЪО(pC=ЃlgxЃЌxБэЪОШмвКжаШмжЪЮЂСЃЕФЮяжЪЕФСПХЈЖШ)ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
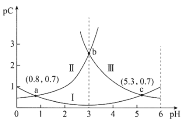
A.ГЃЮТЯТЃЌH2C2O4ЕФKa1=100.8
B.pH=3ЪБЃЌШмвКжа![]()
C.pHгЩ0.8діДѓЕН5.3ЕФЙ§ГЬжаЃЌЫЎЕФЕчРыГЬЖШж№НЅдіДѓ
D.ГЃЮТЯТЃЌЫцзХpHЕФдіДѓЃЌ![]() ЕФжЕЯШдіДѓКѓМѕаЁ
ЕФжЕЯШдіДѓКѓМѕаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ![]() ЛЅЮЊЭЌЗжвьЙЙЬхЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
ЛЅЮЊЭЌЗжвьЙЙЬхЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A. zЕФЖўТШДњЮягаШ§жж
B. xЁЂyЕФвЛТШДњЮяОљжЛгаШ§жж
C. xЁЂyЁЂzжажЛгаxЕФЫљгадзгПЩФмДІгкЭЌвЛЦНУц
D. xЁЂy ПЩЪЙфхЕФЫФТШЛЏЬМШмвКвђЗЂЩњМгГЩЗДгІЖјЭЪЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЭЌбЇгћЬНОПFeCl3ШмвКгыNaHSO3ШмвКЕФЗДгІЃЌЩшМЦЁЂЭъГЩЪЕбщВЂМЧТМШчЯТЃК
зАжУ | ЗДгІЪБМф | ЪЕбщЯжЯѓ |
| 0~1 min | ВњЩњКьКжЩЋГСЕэFe(OH)3ЃЌгаДЬМЄадЦјЮЖЦјЬхSO2внГі |
1~30 min | ГСЕэбИЫйШмНтаЮГЩКьЩЋШмвКЃЌЫцКѓШмвКж№НЅБфЮЊГШЩЋЃЌжЎКѓМИКѕЮоЩЋ | |
30 minКѓ | гыПеЦјНгДЅВПЗжЕФЩЯВуШмвКгжБфЮЊЧГКьЩЋЃЌЫцКѓж№НЅБфЮЊЧГГШЩЋ |
вбжЊЃК Fe(OH)3+SO32-![]()
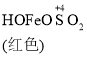
![]()
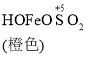
![]() Fe2++SO42-
Fe2++SO42-
ЯТСагаЙиЗДгІЫйТЪКЭЛЏбЇЦНКтЫЕЗЈВЛе§ШЗЕФЪЧ
A. ЩњГЩКьЩЋХфКЯЮяЕФЗДгІЫйТЪНЯПьЃЌКьЩЋХфКЯЮяЩњГЩГШЩЋХфКЯЮяЕФЫйТЪНЯТ§
B. діДѓШмвКжаSO32-ХЈЖШПЩвдМгЫйКьКжЩЋГСЕэFe(OH)3бИЫйШмНт
C. O2ЕФзїгУЯТЃЌГШЩЋHOFeOSO2ХЈЖШЯТНЕЃЌЦНКт![]() ВЛЖЯе§ЯђвЦЖЏ
ВЛЖЯе§ЯђвЦЖЏ
D. 30minЪБЃЌШєЯђИУЮоЩЋШмвКжаЕЮМгЩйСПFeCl3ШмвКЃЌЮоУїЯдЯжЯѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПPbCl2ЪЧвЛжжживЊЕФЛЏЙЄВФСЯЃЌГЃгУзїжњШмМСЁЂжЦБИЧІЛЦЕШШОСЯЁЃЙЄвЕЩњВњжаРћгУЗНЧІПѓОЋПѓЃЈжївЊГЩЗжЮЊPbSЃЌКЌгаFeS2ЕШдгжЪЃЉКЭШэУЬПѓЃЈжївЊГЩЗжЮЊMnO2ЃЉжЦБИPbCl2ЕФЙЄвеСїГЬШчЯТЭМЫљЪОЁЃ
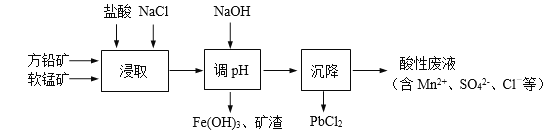
вбжЊЃКi. PbCl2ЮЂШмгкЫЎ
ii. PbCl2 (s) + 2ClЃ(aq) ![]() PbCl42-(aq) ІЄH > 0
PbCl42-(aq) ІЄH > 0
ЃЈ1ЃЉдкНўШЁЧАПѓЪЏбљЦЗвЊЗлЫщЃЌФПЕФЪЧ___________ЁЃ
ЃЈ2ЃЉНўШЁЙ§ГЬжаMnO2гыPbSЗЂЩњШчЯТЗДгІЃЌЧыНЋРызгЗДгІЗНГЬЪНХфЦНЃК
__+__+PbS+__MnO2=PbCl2+______+_______+__
ЃЈ3ЃЉгЩгкPbCl2ЮЂШмгкЫЎЃЌШнвзИНзХдкЗНЧІПѓБэУцаЮГЩЁАЖлЛЏВуЁБЪЙЗДгІЫйТЪДѓДѓНЕЕЭЃЌНўШЁМСжаМгШыБЅКЭNaClШмвКПЩгааЇБмУтетвЛЯжЯѓЃЌдвђЪЧ_______________ЁЃ
ЃЈ4ЃЉЕїНкpHЕФФПЕФЪЧ_________________ЁЃ
ЃЈ5ЃЉЕїНкpHЙ§ТЫКѓЕФТЫвКНјШыГСНЕГиЃЌДгТЫвКжаЛёЕУPbCl2(s)ПЩвдВЩШЁЕФДыЪЉга_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФПЧАЃЌДІРэбЬЦјжа SO2 ГЃВЩгУСНжжЗНЗЈЃКМювКЮќЪеЗЈКЭЫЎУКЦјЛЙдЗЈЁЃ
Ђё.МювКЮќЪеЗЈ
25ЁцЪБЃЌKb(NH3ЁЄH2O)ЃН1.8ЁС10Ѓ5ЃЛH2SO3ЃКKa1ЃН1.5ЁС10Ѓ2ЃЌKa2ЃН1.0ЁС10Ѓ7ЃЛKsp(CaSO4)ЃН7.1ЁС10Ѓ5ЁЃ
Ек1ВНЃКгУЙ§СПЕФХЈАБЫЎЮќЪе SO2ЃЌВЂдкПеЦјжабѕЛЏЃЛ
Ек2ВНЃКМгШыЪЏЛвЫЎЃЌЗЂЩњЗДгІ Ca2ЃЋЃЋ2OHЃЃЋ2NH4ЃЋЃЋSO42ЃCaSO4Ё§ЃЋ2NH3ЁЄH2O KЁЃ
(1)25ЁцЪБЃЌ0.1 molЁЄLЃ1(NH4)2SO3 ШмвКЕФ pH_____(ЬюЁА>ЁБЁА<ЁБЛђЁАЃНЁБ)7ЁЃ
(2)МЦЫуЕк2ВНжаЗДгІЕФ KЃН_____ЁЃ
Ђђ.ЫЎУКЦјЛЙдЗЈ
вбжЊЃКЂй2CO(g)ЃЋSO2(g)=S(l)ЃЋ2CO2(g) ІЄH1ЃНЃ37.0 kJЁЄmolЃ1
Ђк2H2(g)ЃЋSO2(g)=S(l)ЃЋ2H2O(g) ІЄH2ЃНЃЋ45.4 kJЁЄmolЃ1
ЂлCO ЕФШМЩеШШІЄH3ЃНЃ283 kJЁЄmolЃ1
(3)БэЪОвКЬЌСђ(S)ЕФШМЩеШШЕФШШЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
(4)ЗДгІЂкжаЃЌе§ЗДгІЛюЛЏФм E1_____(ЬюЁА>ЁБЁА<ЁБЛђЁАЃНЁБ)ІЄH2ЁЃ
(5)дквЛЖЈбЙЧПЯТЃЌЗЂЩњЗДгІЂйЁЃЦНКтЪБSO2ЕФзЊЛЏТЪІС(SO2)гыЭЖСЯБШЕФБШжЕ[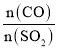 ЃНy]ЁЂЮТЖШ T ЕФЙиЯЕШчЭМЫљЪОЁЃ
ЃНy]ЁЂЮТЖШ T ЕФЙиЯЕШчЭМЫљЪОЁЃ
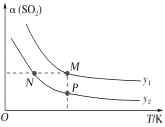
БШНЯЦНКтЪБCOЕФзЊЛЏТЪІС(CO)ЃКN_____MЁЃФцЗДгІЫйТЪЃКN_____P(ЬюЁА>ЁБЁА<ЁБЛђЁАЃНЁБ)ЁЃ
(6)ФГЮТЖШЯТЃЌЯђ10LКуШнУмБеШнЦїжаГфШы2molH2ЁЂ2 molCOКЭ2molSO2ЗЂЩњЗДгІЂйЁЂЂкЃЌЕк5minЪБДяЕНЦНКтЃЌВтЕУЛьКЯЦјЬхжаCO2ЁЂH2O(g)ЕФЮяжЪЕФСПЗжБ№ЮЊ1.6 molЁЂ1.8 molЁЃ
ЂйИУЮТЖШЯТЃЌЗДгІЂкЕФЦНКтГЃЪ§KЮЊ_____ЁЃ
ЂкЦфЫћЬѕМўВЛБфЃЌдкЕк 7 min ЪБЫѕаЁШнЦїЬхЛ§ЃЌSO2ЕФЦНКтХЈЖШ_____(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЁАБЪЁЂФЋЁЂжНЁЂбтЁБдкжаЙњДЋЭГЮФЛЏжаБЛГЦЮЊЁАЮФЗПЫФБІЁБЃЌЯТСаЫЕЗЈжаДэЮѓЕФЪЧЃЈ ЃЉ
A | B | C | D |
|
|
|
|
гУзЦЩеЗЈПЩМјБ№бђКСгыФсСњКСЕФецЮБ | ФЋЕФжївЊГЩЗжЪЧЬМЕЅжЪ | жНЕФжївЊГЩЗжЪєгкКЯГЩВФСЯ | гУЪЏВФжЦзїбтЬЈЕФЙ§ГЬЪЧЮяРэБфЛЏ |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com