
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[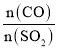 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
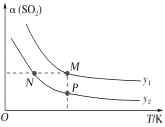
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
【答案】> 4.3×1013 S(l)+O2(g)=SO2(g) ΔH=-529 kJ·mol-1 > > < 2700 增大
【解析】
(1)根据Kb(NH3H2O)=1.8×10-5>Ka2(H2SO3)=1.0×10-7,分析判断;
(2)第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3H2O,化学平衡常数K=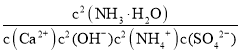 ,结合电离平衡常数和溶度积常数分析计算;
,结合电离平衡常数和溶度积常数分析计算;
(3)根据盖斯定律分析解答;
(4)根据焓变△H2=E1-E2结合反应②为吸热反应分析判断;
(5)反应①的正反应是气体体积减小的放热反应,温度相同、投料比的比值[ =y]越大,SO2的转化率α越大;投料比相同时,温度越高,SO2的转化率α越低,据此分析解答;
=y]越大,SO2的转化率α越大;投料比相同时,温度越高,SO2的转化率α越低,据此分析解答;
(6)①根据三段式结合平衡常数K= 计算;②其他条件不变,在第7min时缩小容器体积,即使容器的压强增大,化学平衡正向移动,据此分析判断。
计算;②其他条件不变,在第7min时缩小容器体积,即使容器的压强增大,化学平衡正向移动,据此分析判断。
(1)由于Kb(NH3H2O)=1.8×10-5>Ka2(H2SO3)=1.0×10-7,根据盐的水解规律:“谁弱谁水解,谁强显谁性”可知,(NH4)2SO3溶液呈碱性,pH>7;故答案为:>;
(2)第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3H2O 化学平衡常数K=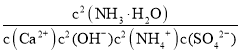 =
=![]() =
=![]() =4.3×1013,故答案为:4.3×1013;
=4.3×1013,故答案为:4.3×1013;
(3)①2CO(g)+SO2(g)S(l)+2CO2(g) △H1=-37.0kJ/mol,②2H2(g)+SO2(g)=S(l)+2H2O(g) △H2=+45.4kJ/mol,CO的燃烧热△H3=-283kJ/mol,即③CO(g)+![]() O2(g)=CO2(g) △H3=-283kJ/mol,根据盖斯定律③×2-①计算S(l)+O2(g)=SO2(g)的△H=(-283kJ/mol)×2 - (-37.0kJ/mol)=-529kJ/mol,热化学方程式为S(l)+O2(g)=SO2(g) △H=-529kJ/mol,故答案为:S(l)+O2(g)=SO2(g) △H=-529kJ/mol;
O2(g)=CO2(g) △H3=-283kJ/mol,根据盖斯定律③×2-①计算S(l)+O2(g)=SO2(g)的△H=(-283kJ/mol)×2 - (-37.0kJ/mol)=-529kJ/mol,热化学方程式为S(l)+O2(g)=SO2(g) △H=-529kJ/mol,故答案为:S(l)+O2(g)=SO2(g) △H=-529kJ/mol;
(4)反应②的正反应为吸热反应,焓变△H2=E1-E2(逆反应活化能)>0,E1=E2+△H2,由于E2>0,所以E1>△H2,故答案为:>;
(5)反应①的正反应是气体体积减小的放热反应,温度相同、投料比的比值[ =y]越大,SO2的转化率α越大、CO的转化率越小,即y1>y2,投料比相同时,温度越高,SO2的转化率α越低,所以N点的投料比小、温度低,则CO的转化率大于M点CO的转化率;N、P投料比相同,但P点温度高,所以P点反应速率大于N点,逆反应速率:N<P,故答案为:>;<;
=y]越大,SO2的转化率α越大、CO的转化率越小,即y1>y2,投料比相同时,温度越高,SO2的转化率α越低,所以N点的投料比小、温度低,则CO的转化率大于M点CO的转化率;N、P投料比相同,但P点温度高,所以P点反应速率大于N点,逆反应速率:N<P,故答案为:>;<;
(6)①对于 2CO(g)+SO2(g)S(l)+2CO2(g)
开始(mol/L) 0.2 0.2 0
变化(mol/L) 0.16 0.08 0.16
平衡(mol/L) 0.04 0.12 .16
对于2H2(g)+SO2(g)S(l)+2H2O(g)
开始(mol/L) 0.2 0.12 0
变化(mol/L) 0.18 0.09 0.18
平衡(mol/L) 0.02 0.03 0.18
所以反应②的化学平衡常数K= =
=![]() =2700,故答案为:2700;
=2700,故答案为:2700;
②其他条件不变,在第7min时缩小容器体积,即使容器的压强增大,由于两个反应的正反应都是气体体积减小的反应,所以缩小体积,容器的压强增大,化学平衡正向移动,二氧化硫的物质的量减小,但由于容器体积减小,所以二氧化硫的浓度仍然会增大,故答案为:增大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. HC1的电子式:![]() B. CO2的比例模型:
B. CO2的比例模型: ![]()
C. 乙酸的分子式:CH3COOH D. 甲烷的实验式为CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
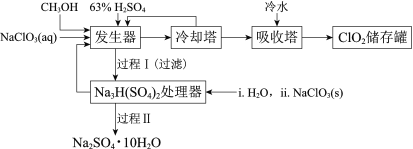
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
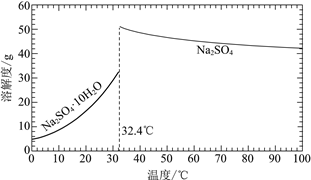
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H![]() ②CH4 ③OH- ④NH
②CH4 ③OH- ④NH![]() ⑤Fe(CO)3
⑤Fe(CO)3
⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
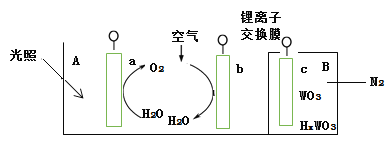
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2 TiCl4+2CO。回答下列相关问题:
TiCl4+2CO。回答下列相关问题:
(1)基态钛原子的价层电子排布式为____ ,上述反应中非金属元素电负性由大到小是______;
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 1830 | 3550 | -24.1 | 38 | 150 |
沸点/℃ | 2927 | 4827 | 136.4 | 233.1 | 377.2 |
自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是__________。
(3)配位数为6,组成为TiCl36H2O 的晶体有两种:化学式为[TiCl(H2O)5]Cl2H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3 以1:3物质的量之比反应生成沉淀,则Y的化学式为 ______。
(4)钙钛矿是重要的含钛矿物之一。其主要成分Z 的晶胞如图所示。推测Z的化学式为__________,Ca填充在O围成的_________空隙中。

(5)若晶胞参数 a=384.1pm,Z晶体的密度为 _________列出计算表达式并计算出两位有效数字结果,3.8413≈56.67,阿伏加德罗常数用 6.0×1023 mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的下列有机物,充分燃烧,消耗氧气的量相同的是
A. C3H4和C2H6B. C3H6和C3H8O
C. C3H6O2和C3H8OD. C3H8O和C4H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)往2L密闭容器中充入1molN2和3molH2,在一定条件下发生合成氨反应,2min时达到平衡。测得平衡混合气体中NH3的体积分数为25%,则:
①0~2min内,v(NH3)=_________。
②H2在平衡混合气中的体积分数=_________。
③平衡时容器的压强与起始时的压强之比为_________。
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
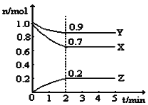
①该反应的化学方程式为_____________。
②2min反应达平衡容器内混合气体的平均相对分子质量比起始时____________(填“大”,“小”或“相等”下同),混合气体密度比起始时____________。
③上述反应在第2min时,X的转化率为_________
④将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置.B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置.

(1)写出装置A中发生反应的化学方程式____________。
(2)C中盛有____________,目的是_____________。
(3)写出装置D中发生反应的化学方程式__________。
(4)指出装置E的错误_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com