
【题目】以下微粒含配位键的是( )
①N2H![]() ②CH4 ③OH- ④NH
②CH4 ③OH- ④NH![]() ⑤Fe(CO)3
⑤Fe(CO)3
⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧ B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧ D. 全部
【答案】C
【解析】①氢离子提供空轨道,N2H4氮原子提供孤电子对,所以能形成配位键,N2H5+含有配位键;②甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键;③OH-电子式为![]() ,无空轨道,OH-不含有配位键;④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键;⑤Fe3+有空轨道,CO中的氧原子上的孤电子对,可以形成配位键,Fe(CO)3含有配位键;⑥SCN-的电子式
,无空轨道,OH-不含有配位键;④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键;⑤Fe3+有空轨道,CO中的氧原子上的孤电子对,可以形成配位键,Fe(CO)3含有配位键;⑥SCN-的电子式![]() ,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键;⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,Ag(NH3)2OH含有配位键;故选C。
,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键;⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,Ag(NH3)2OH含有配位键;故选C。


科目:高中化学 来源: 题型:
【题目】由下列实验及现象能推出相应结论的是( )
实验 | 实验现象 | 实验结论 | |
A | 用洁净的铂丝蘸取少量溶液在酒精灯外焰上灼烧 | 火焰呈黄色 | 该溶液中一定含有Na+,无K+ |
B | 向某溶液中加入BaCl2溶液 | 有白色沉淀 | 该溶液中一定有SO |
C | 将某气体通入品红溶液 | 红色褪去 | 该气体一定是SO2 |
D | 将一小块用砂纸打磨过的铝箔在酒精灯上加热 | 熔化的液态铝不会滴落 | 表面生成的Al2O3薄膜熔点较高 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的二元弱酸H2C2O4溶液中逐滴加入NaOH溶液,pC与溶液pH的变化关系如图所示(pC=-lgx,x表示溶液中溶质微粒的物质的量浓度)。下列说法正确的是
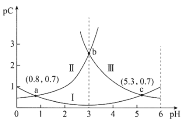
A.常温下,H2C2O4的Ka1=100.8
B.pH=3时,溶液中![]()
C.pH由0.8增大到5.3的过程中,水的电离程度逐渐增大
D.常温下,随着pH的增大,![]() 的值先增大后减小
的值先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲探究FeCl3溶液与NaHSO3溶液的反应,设计、完成实验并记录如下:
装置 | 反应时间 | 实验现象 |
| 0~1 min | 产生红褐色沉淀Fe(OH)3,有刺激性气味气体SO2逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
已知: Fe(OH)3+SO32-![]()
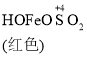
![]()
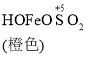
![]() Fe2++SO42-
Fe2++SO42-
下列有关反应速率和化学平衡说法不正确的是
A. 生成红色配合物的反应速率较快,红色配合物生成橙色配合物的速率较慢
B. 增大溶液中SO32-浓度可以加速红褐色沉淀Fe(OH)3迅速溶解
C. O2的作用下,橙色HOFeOSO2浓度下降,平衡![]() 不断正向移动
不断正向移动
D. 30min时,若向该无色溶液中滴加少量FeCl3溶液,无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。
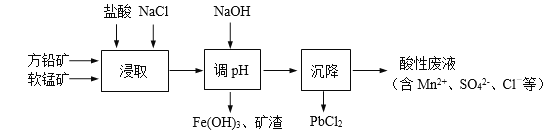
已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq) ![]() PbCl42-(aq) ΔH > 0
PbCl42-(aq) ΔH > 0
(1)在浸取前矿石样品要粉碎,目的是___________。
(2)浸取过程中MnO2与PbS发生如下反应,请将离子反应方程式配平:
__+__+PbS+__MnO2=PbCl2+______+_______+__
(3)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是_______________。
(4)调节pH的目的是_________________。
(5)调节pH过滤后的滤液进入沉降池,从滤液中获得PbCl2(s)可以采取的措施有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[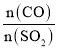 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
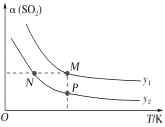
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物完全燃烧生成CO2和水。将12g该有机物完全燃烧的产物通过浓硫酸,浓硫酸增重14.4g;再通过碱石灰,碱石灰增重26.4g,该有机物的分子式为( )
A. C4H10OB. C2H6OC. C3H8OD. C2H4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1-溴丙烷在不同条件下的反应及各物质转化关系如图所示:
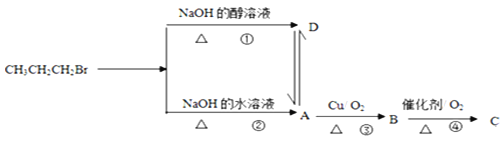
(1)D物质的结构简式为_____________,试写出反应②的化学反应方程式:________________。
(2)有机物A可以金属钠反应,试写出该反应的化学方程式_______________________________。
(3)B物质中可能含有的官能团是_________________。检验该官能团常用以下哪种试剂________
A. 浓硫酸 B.NaOH溶液 C.无水硫酸铜 D.新制氢氧化铜悬浊液
该反应的原理是____________________________________________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com