
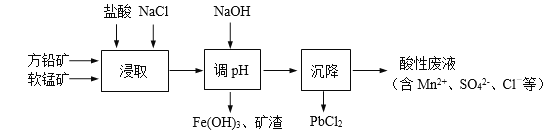
����Ŀ��PbCl2��һ����Ҫ�Ļ������ϣ����������ܼ����Ʊ�Ǧ�Ƶ�Ⱦ�ϡ���ҵ���������÷�Ǧ����Ҫ�ɷ�ΪPbS������FeS2�����ʣ������̿���Ҫ�ɷ�ΪMnO2���Ʊ�PbCl2�Ĺ�����������ͼ��ʾ��
��֪��i. PbCl2����ˮ
ii. PbCl2 (s) + 2Cl��(aq) ![]() PbCl42-(aq) ��H > 0
PbCl42-(aq) ��H > 0
��1���ڽ�ȡǰ��ʯ��ƷҪ���飬Ŀ����___________��
��2����ȡ������MnO2��PbS�������·�Ӧ���뽫���ӷ�Ӧ����ʽ��ƽ��
__+__+PbS+__MnO2=PbCl2+______+_______+__
��3������PbCl2����ˮ���������ڷ�Ǧ������γ����ۻ�����ʹ��Ӧ���ʴ�ͣ���ȡ���м��뱥��NaCl��Һ����Ч������һ����ԭ����_______________��
��4������pH��Ŀ����_________________��
��5������pH���˺����Һ��������أ�����Һ�л��PbCl2(s)���Բ�ȡ�Ĵ�ʩ��_________��
���𰸡�����Ӧ��Ӵ��������߷�Ӧ���� 8H�� 2Cl�� 4 4Mn2+ SO42�� 4H2O PbCl2 (s) + 2Cl��(aq) ![]() PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ������� ��ȥ��Һ�е�Fe3+ ��ˮϡ�͡�����
PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ������� ��ȥ��Һ�е�Fe3+ ��ˮϡ�͡�����
��������
��Ǧ����Ҫ�ɷ�ΪPbS������FeS2�����ʣ������̿���Ҫ�ɷ�ΪMnO2���м���ϡ���ᣬ�������Է�Һ�к�����������ӿ�֪PbS��SԪ�ر���������������ӣ������Ȼ��ƴٽ���ӦPbCl2(s) + 2Cl��(aq)![]() PbCl42�� (aq)�������������Ƶ���pH��ʹ������ת��Ϊ�����������������˵õ�������������������Һ��PbCl2����ˮ������Һ�������˵õ�PbCl2���ݴ˽��
PbCl42�� (aq)�������������Ƶ���pH��ʹ������ת��Ϊ�����������������˵õ�������������������Һ��PbCl2����ˮ������Һ�������˵õ�PbCl2���ݴ˽��
��1���ڽ�ȡǰ��ʯ��ƷҪ���飬Ŀ��������Ӧ��Ӵ��������߷�Ӧ���ʣ��ʴ�Ϊ������Ӧ��Ӵ��������߷�Ӧ���ʡ�
��2����ȡ������MnO2��PbS������Ӧ4MnO2+ PbS+8HCl=3MnCl2+ PbCl2+MnSO4+4H2O�����ӷ���ʽΪ8H++2Cl-+4MnO2+ PbS= PbCl2+4Mn2++ SO42-+4H2O���ʴ�Ϊ��8H����2Cl����4 ��4Mn2+ ��SO42���� 4H2O��
��3����ȡ���м��뱥��NaCl��Һ����Ч������һ����ԭ����PbCl2 (s) + 2Cl��(aq) ![]() PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ��㡱���ʴ�Ϊ��PbCl2 (s) + 2Cl��(aq)
PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ��㡱���ʴ�Ϊ��PbCl2 (s) + 2Cl��(aq) ![]() PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ��㡱��
PbCl42�� (aq)������NaCl����c(Cl��)��������ƽ�������ƶ�����PbCl2 (s)ת��Ϊ��Һ�е����ӣ��������ۻ��㡱��
��4���������̿�֪��������Һ��pH,ʹ������ת��Ϊ��������������ȥ��Һ�е�Fe3+���ʴ�Ϊ����ȥ��Һ�е�Fe3+��
��5����֪PbCl2(s) + 2Cl��(aq)![]() PbCl42-(aq) ��H��0����ͨ����ˮϡ�ͣ����´ٽ���Ӧ������У����PbCl2���ʴ�Ϊ����ˮϡ�͡����¡�
PbCl42-(aq) ��H��0����ͨ����ˮϡ�ͣ����´ٽ���Ӧ������У����PbCl2���ʴ�Ϊ����ˮϡ�͡����¡�


 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Li4Ti5O12��LiFePO4��������ӵ�صĵ缫���ϣ�������������(��Ҫ�ɷ�ΪFeTiO3������������MgO��SiO2������)���Ʊ��������������£�

�ش��������⣺
(1)Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�����й���������ĿΪ__________________��
(2)���������Ҫ��TOCl42-��ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ_________________��
(3)����ͬѧȡ2 mL FeCl2��Һ�����뼸����ˮ���ټ���1��KSCN��Һ����Һ��죬˵��Cl2�ɽ�Fe2��������FeCl2��Һ����ˮ��Ӧ�����ӷ���ʽΪ_________________________________________
����ͬѧ��ʢ��H2O2��Һ���Թ��м��뼸���ữ��FeCl2��Һ����Һ����ػ�ɫ��������Ӧ�����ӷ���ʽΪ____________��
(4)��6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72-��ԭ��Cr3������Ӧ�����ӷ���ʽΪ___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����������Ӧ����ʽΪ____________�������������ϸ�ΪCH4��д���为����Ӧ����ʽ___________��
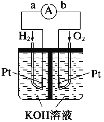
(2)NH3���������з�ȼ�ϵ���ǵ�ǰ���е�һ���ȵ㡣ʹ�õĵ������Һ��2 mol��L-1��KOH��Һ������ܷ�ӦΪ��4NH3+3O2��2N2+6H2O���õ�ظ����ĵ缫��ӦʽΪ__________��ÿ����3.4g NH3ת�Ƶĵ�����ĿΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�ClO2���㷺Ӧ����ֽ��Ư�ס�ɱ��������ˮ��������������ҵ�����ü״���ԭNaClO3�ķ����Ʊ�ClO2�������������£�
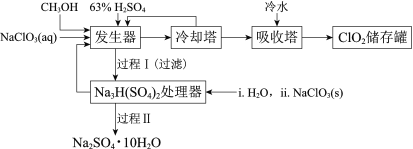
��֪��a�����������Ʊ�ClO2�ķ�Ӧ��12NaClO3+8H2SO4+3CH3OH= 12ClO2��+3HCOOH+4Na3H(SO4)2��+9H2O
b��������ʵ��۷е㣺
���� | CH3OH | HCOOH | ClO2 |
�۵�/�� | ��97 | 9 | ��59 |
�е�/�� | 65 | 101 | 11 |
(1)ClO2������ֽ��Ư�ס�ɱ���������������______�ԡ�
(2)��ȴ�����ڷ���ClO2������CH3OH��Ӧ���Ƶ�����¶�Ϊ______������ĸ����
A��0~10�� B��20~30�� C��60~70��
(3)�����̢���̢���Ի��â����Na2SO4��10H2O����ʹ����ԭ��ѭ�����á�
��֪��Na2SO4��10H2O��Na2SO4���ܽ����������ͼ��
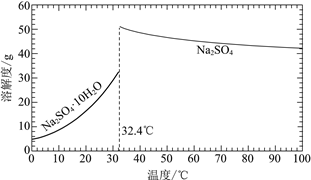
��Na3H(SO4)2�������л��â��ʱ�����NaClO3���壬��â���ܽ�ƽ��ĽǶȽ�����ԭ��______��
�ڽ��Na2SO4��10H2O��Na2SO4���ܽ�����ߣ����̢�IJ����ǣ���32.4�����������______��
��Na3H(SO4)2����������Һ�п���ѭ�����õ�ԭ����NaClO3��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.20 mol/LKMnO4������Һ 0.l0L��һ����pH=3.0�IJ���(HOOC-COOH)��Һ��ϣ��ų�VL���塣NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.9 g HOOC-COOH�����õ��Ӷ���ĿΪ0.9NA
B.��0.01mol KMnO4 ����ԭʱ��ǿ���ṩ��H+��ĿΪ 0.01NA
C.pH=3.0�IJ�����Һ����H+��ĿΪ0.001NA
D.�÷�Ӧ�ͷ� CO2������ĿΪVNA/22.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������λ������(����)
��N2H![]() ����CH4����OH-����NH
����CH4����OH-����NH![]() ����Fe(CO)3
����Fe(CO)3
��Fe(SCN)3����H3O������[Ag(NH3)2]OH
A. �٢ڢܢߢ� B. �ۢܢݢޢ�
C. �٢ܢݢޢߢ� D. ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̫��ˮ�����װ����ͼ��ʾ���õ���������缫��ɣ�����aΪTiO2�缫��bΪPt�缫��cΪWO3�缫���������ҺΪpH=3��Li2SO4-H2SO4��Һ������ӽ���Ĥ����ط�ΪA��B��������A����� ����ͨ��B��Ϊ�����ϵ����N2���������й��ڸõ�ص�˵��������ǣ� ��
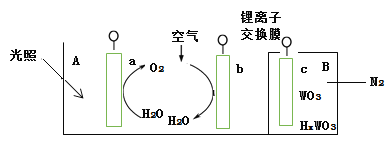
A.���õ�������a��c,��aΪ�������õ缫����pH��С
B.���õ�������a��c,��c�缫�ĵ缫��ӦʽΪHxWO3 - xe- =WO3 + xH+
C.���õ���������a��c,������b��c,��ʵ��̫���������ת��
D.���õ�������b��c, b�缫�ĵ缫��ӦʽΪO2+4H++4e-=2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ���ʵ����������л�����ȼ�գ���������������ͬ����
A. C3H4��C2H6B. C3H6��C3H8O
C. C3H6O2��C3H8OD. C3H8O��C4H8O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ����������£�����ѡ����ʾ�����ʼ�ת������һ��ʵ�ֵ���
A.NaCl(aq) ![]() NaHCO3
NaHCO3![]() NaCO3
NaCO3
B.Al![]() NaAlO2
NaAlO2![]() AlCl3(aq)
AlCl3(aq) ![]() AlCl3(s)
AlCl3(s)
C.Fe![]() FeCl2
FeCl2![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3
D.H2SO4(aq) ![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO3
(NH4)2SO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com