
【题目】在给定的条件下,下列选项所示的物质间转化均能一步实现的是
A.NaCl(aq) ![]() NaHCO3
NaHCO3![]() NaCO3
NaCO3
B.Al![]() NaAlO2
NaAlO2![]() AlCl3(aq)
AlCl3(aq) ![]() AlCl3(s)
AlCl3(s)
C.Fe![]() FeCl2
FeCl2![]() Fe(OH)2
Fe(OH)2![]() Fe(OH)3
Fe(OH)3
D.H2SO4(aq) ![]() SO2
SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO3
(NH4)2SO3
科目:高中化学 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。
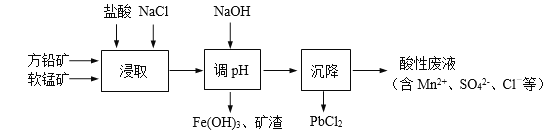
已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq) ![]() PbCl42-(aq) ΔH > 0
PbCl42-(aq) ΔH > 0
(1)在浸取前矿石样品要粉碎,目的是___________。
(2)浸取过程中MnO2与PbS发生如下反应,请将离子反应方程式配平:
__+__+PbS+__MnO2=PbCl2+______+_______+__
(3)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是_______________。
(4)调节pH的目的是_________________。
(5)调节pH过滤后的滤液进入沉降池,从滤液中获得PbCl2(s)可以采取的措施有_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
A.达到平衡时,4v(O2)正=5v(NO)逆
B.达到平衡状态后,NH3 、O2 、NO 、H2O(g)的物质的量保持不变。
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A | B | C | D |
|
|
|
|
用灼烧法可鉴别羊毫与尼龙毫的真伪 | 墨的主要成分是碳单质 | 纸的主要成分属于合成材料 | 用石材制作砚台的过程是物理变化 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列七种有机物中:
A.CH4 B.CH2=CH2 C.![]()
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
(1)酸性比碳酸强的是______(填字母编号,下同).
(2)易发生银镜反应的是______.(3)具有正四面体结构的是______.
(4)通常用于检验碘单质的是______.(5)可用于合成聚乙烯塑料的是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1-溴丙烷在不同条件下的反应及各物质转化关系如图所示:
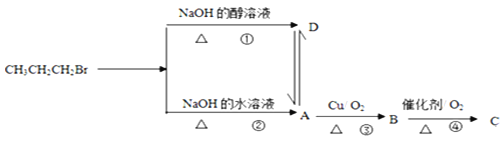
(1)D物质的结构简式为_____________,试写出反应②的化学反应方程式:________________。
(2)有机物A可以金属钠反应,试写出该反应的化学方程式_______________________________。
(3)B物质中可能含有的官能团是_________________。检验该官能团常用以下哪种试剂________
A. 浓硫酸 B.NaOH溶液 C.无水硫酸铜 D.新制氢氧化铜悬浊液
该反应的原理是____________________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种重要的结构陶瓷材料,可用作LED的基质材料,通过等离子法由SiH4(沸点-111.9℃)与氨气反应制取的方程式如下:3SiH4+4NH3=Si3N4+12H2。设NA是阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,1.8gSiH4所含质子的数目为3.2NA
B.标准状况下,4.48LNH3和H2的混合气体所含分子总数为0.2NA
C.NA个NH3分子溶于1L的水,所得溶液的物质的量浓度为1mol·L-1
D.当生成1molSi3N4时,转移电子数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组成员为研究金属铜与强酸的反应 ,将6.4g铜粉分为两等份,进行了如下实验,请完成有关计算。
(1)取其中一份铜粉投入200mL氢离子浓度为 1molL-1 硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前混合溶液中硫酸的物质的量浓度为_________(写出计算过程)。
(2)用NaOH溶液吸收氮氧化物是防止NO2污染的一种方法。原理为2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O,NO + NO2 + 2NaOH=2NaNO2 + H2O。取另一份铜粉溶于过量的硝酸溶液,假设硝酸的还原产物只有一氧化氮和二氧化氮,生成的混合气体能被amol NaOH溶液完全吸收,试讨论a的取值范围:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com