
����Ŀ����һ���¶��µ�2L�̶��ݻ����ܱ������У�ͨ��2mol CO2��3mol H2 �� �����ķ�ӦΪCO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��akJmol��1��a��0�������CO2��g����CH3OH��g����Ũ����ʱ��仯��ͼ��ʾ��
����˵���÷�Ӧ�Ѵ�ƽ��״̬���������ţ���
A����λʱ����ÿ����1.2mol H2 �� ͬʱ����0.4mol H2O
B��CO2����������ڻ�������б��ֲ���
C����������ƽ����Է�����������ʱ��ı仯���仯
D������ϵ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ���
����ҪʹK=1����ı����������������ѡ���
A������ѹǿ B����Сѹǿ C�������¶� D�������¶� E�����������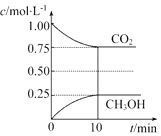
���𰸡�BC��D
���������⣺��A�����۷�Ӧ�Ƿ�ﵽƽ��״̬�����ڵ�λʱ����ÿ����1.2mol H2 �� ͬʱ����0.4mol H2O�����Բ��ܾݴ��ж�ƽ��״̬���ʴ��� B��CO2����������ڻ�������б��ֲ���ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ�� C����Ӧǰ������������ʵ�����С����������������䣬���Է�Ӧǰ��������ƽ����Է�������������������ƽ����Է�����������ʱ��ı仯���仯ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ�� D�����۷�Ӧ�Ƿ�ƽ�ⶼ���ڸ���ϵ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1��1���ұ��ֲ��䣬���Բ��ܾݴ��ж�ƽ��״̬���ʴ���
��ѡBC���ڿ�ʼc��CO2��= ![]() =1mol/L��c��H2��=
=1mol/L��c��H2��= ![]() =1.5mol/L��
=1.5mol/L��
����ʽ��
CO2��g��+ | 3H2��g�� | CH3OH��g��+ | H2O��g�� | ||
��ʼ��mol/L�� | 1 | 1.5 | 0 | 0 | |
��Ӧ��mol/L�� | 0.25 | 0.75 | 0.25 | 0.25 | |
ƽ�⣨mol/L�� | 0.75 | 0.75 | 0.25 | 0.25 |
��ѧƽ�ⳣ��K= ![]() =
= ![]() ��
��
��ѧƽ�ⳣ��ֻ���¶��йأ�Ҫ�ı仯ѧƽ�ⳣ��ֻ�ܸı��¶ȣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ��Ҫʹƽ�ⳣ������Ӧ�ý����¶ȣ���ѡD��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���жϣ���Ҫ�˽�״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���Ȳ��ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10.2 g��þ����Ͷ��1000 ml 2 mol/L�������У�������ȫ�ܽ⣺�ټ���4 mol/L��NaOH��Һ����Ҫʹ���ɵij�����࣬��Ӧ����NaOH��Һ������ǣ� ��
A. 100 ml B. 700 ml C. 600 ml D. 500 ml
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�Һ�������ӻ�����K=c��NH4+��c��NH2����=1.6��10��29 �� ���ö���pHһ�����涨pN=��lg c��NH4+�������ڸ��¶��£�����������ȷ���ǣ� ��
A.������Һ���У�pN=7
B.������Һ���У�c��NH4+��c��NH2������1.0��10��14
C.1 L�ܽ���0.001 mol NH4C1��Һ����Һ����pN=3
D.1 L�ܽ���0.001 mol NaNH2��Һ����Һ����pN=11
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��ԭ����װ�á���������۵������У���ȷ�ģ���ʵ���ܴﵽԤ��Ŀ�ģ��У��й�װ���еļг�������ȥδ������ ���� 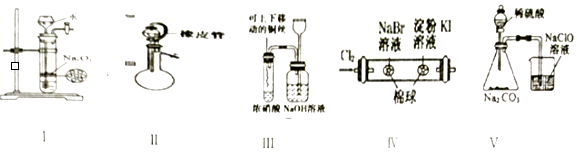
������շ�����������������װ�ü�������ԣ�ֹˮ���ѹأ�һ��Һ©��������Һ��˳������
�����ͭ��Ũ���ᷴӦ��ʵ�����֤��������Cl2��Br2��I2������֤���Ե�ǿ����H2SO4��H2CO3��HClO��
A.1��
B.2��
C.3��
D.4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з���ʽ�ܱ�ʾ������ֻ��һ�ֵ��ǣ� ��
A.C5H10
B.CH4O
C.C7H8O
D.C2H4Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǣ� ��
A.�ý����ƿ������Ҵ�������
B.�ø������������Һ�����ּ����3����ϩ
C.��ˮ�����ֱ����屽
D.��������Ȼ�̼��Һ��������ϩ����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ״���£�ij��̬��1���ֻ����1������������ӳɷ�Ӧ�������ȴ��������ȴ���1mol����6mol����������ȫȡ����Ӧ��������Ľṹ��ʽ�ǣ� ��
A.CH2=CH2
B.CH3CH=CH2
C.CH3CH3
D.CH3CH2CH=CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����ⶨij�Ѳ��ֱ��ʵ�С�մ���Ʒ��Na2CO3�������������������ʵ�鷽����
������һ����ȡһ��������Ʒ�����������м��������غ�����ȴ������ʣ��������������㡣
��1�������з�����Ӧ�Ļ�ѧ����ʽΪ_______________��
��2��ʵ���У�����������ص�Ŀ����_______________��
������������ȡһ��������Ʒ������С�ձ��У�������ˮ�ܽ�����С�ձ��м�������Ba(OH)2��Һ��������ϴ�ӡ���������������������������㡣(��֪:Ba2++OH-+HCO3-==BaCO3��+H2O)
��1�����˲������������ձ���©��������Ҫ�õ��IJ�������Ϊ_______________��
��3��ʵ�����жϳ����Ƿ���ȫ�ķ�����_______________��
����������������ͼ��ʾװ�ý���ʵ��:
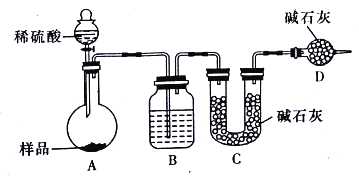
��1��Dװ�õ�������_______________����Һ©����_________(������������������)���������ϡ�������ʵ�顣
��2��ʵ��ǰ��ȡ17.90g��Ʒ��ʵ�����Cװ������8.80g������Ʒ��Na2CO3����������Ϊ________________(������λ��Ч����)
��3�����ݴ�ʵ���õ����ݣ��ⶨ������������Ϊʵ��װ�û������һ������ȱ����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȼ�ŵ�H2S����ͨ��ʢ��һ����O2�ļ���ƿ�С�������Ϩ������ͨ��H2S����������Ҫ��Ӧ��
A.2H2S+O2=2S+2H2OB.2H2S+3O2=2SO2+2H2O
C.2H2S+SO2=3S+2H2OD.2SO2+O2=2SO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com