
【题目】相同状况下,某气态烃1体积只能与1体积氯气发生加成反应,生成氯代烃,此氯代烃1mol可与6mol氯气发生完全取代反应,则该烃的结构简式是( )
A.CH2=CH2
B.CH3CH=CH2
C.CH3CH3
D.CH3CH2CH=CH2
科目:高中化学 来源: 题型:
【题目】下列有关碱金属的叙述正确的是 ( )
A. 碱金属单质和氧气反应时都会生成同类产物
B. 碱金属单质的硬度都较大
C. 液态的钠可用作核反应堆的传热介质
D. 碱金属单质都是银白色的固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,则下列说法不正确的是( )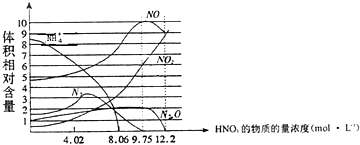
A.一般来说,硝酸与铁反应的还原产物不是单一的
B.用一定量的铁粉与大量的9.75molL﹣1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol.
C.硝酸的浓度越大,其还原产物中价态越高的成份越多
D.当硝酸浓度为9.75molL﹣1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2 , 发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
①能说明该反应已达平衡状态的是(填编号).
A.单位时间内每消耗1.2mol H2 , 同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②若要使K=1,则改变的条件可以是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂.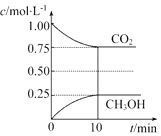
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种过渡金属,外观呈现银白色,在现代工业中对于电池制造上有不可磨灭的地位.现代炼锌的方法可分为火法和湿法两大类.硫酸铅是生产锌的副产品.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1473﹣1573K,使锌蒸馏出来.将闪锌矿焙烧使它转化为氧化锌的主要化学反应方程式为 .
(2)某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: 
回答下列问题:
①焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的操作.
②浸出液“净化”过程中加入的主要物质为锌粉,其作用是 .
③改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生的主要反应的离子方程式为
(3)工业冶炼锌的过程中,会产生铅浮渣(主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质),某科研小组研究利用铅浮渣生产硫酸铅的流程如下: 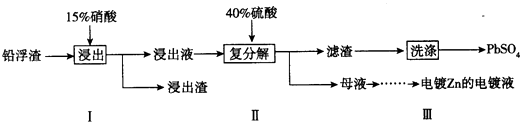
已知:25℃时,Ksp(CaSO4)=4.9×10﹣5 , KSP(PbSO4)=1.6×10﹣8 .
①已知步骤Ⅰ有NO气体产生,浸出液中含量最多的阳离子是Pb2+ . 写出Pb参加反应的化学方程式
②步骤Ⅰ需控制Pb的用量并使Pb稍有剩余,目的是 , 产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是 .
③母液中可循环利用的溶质的化学式是(填一种物质);母液经过处理可得电镀Zn时电解质溶液,在铁棒上镀锌时,阳极材料为 .
(4)银锌电池是一种常见电池,电池的总反应式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2 , 电解质溶液为KOH溶液,电池工作时正极的电极式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2 , 发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
①能说明该反应已达平衡状态的是(填编号).
A.单位时间内每消耗1.2mol H2 , 同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②若要使K=1,则改变的条件可以是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com