
苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
已知:
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |

(1)C (2分)
(2)使平衡不断正向移动(2分)
(3)C(2分)
(4)除去硫酸和未反应的苯甲酸(2分,回答一点得1分)
苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华(2分)
(5)AD(2分,正确但不全1分,有错0分)
(6)90.02% (2分,答90%也得分)
解析试题分析:(1)用烧瓶加热液体时,不能少于容积的1/4,不能超过2/3;(2)该反应为可逆反应,分离出水,可使平衡向正反应方向移动;(3)步骤②中环己烷的沸点为80.8℃,所以加热到85~90℃;(4)步骤③加入Na2CO3的作用是除去硫酸和未反应的苯甲酸;若Na2CO3加入不足,苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华;(5)分液漏斗应放在铁架台上静置分层;(6)产率=实际产量/理论产量。
考点:以有机物的制备为背景考查化学实验基础、物质的分离提纯、化学计算。


科目:高中化学 来源: 题型:实验题
(14分)某物质用途广泛,可用作分析试剂、媒染剂、催化剂及化工原料。经测定它含有铁元素,摩尔质量为482g/mol。为进一步确定它的组成,某化学兴趣小组做了以下实验:
Ⅰ.称取48.20g该物质溶于水,配成100mL溶液,所得溶液显棕黄色。
Ⅱ.取上述溶液50mL于试管中,加入足量的0.1mol/LNaOH溶液,并加热,产生的气体经干燥后通入浓硫酸中,浓硫酸增重0.85g;产生的红褐色沉淀经过过滤、洗涤、灼烧后得4.00g固体。
Ⅲ.另取上述溶液50mL于试管中,加入足量的BaCl2溶液,产生不溶于盐酸的白色沉淀 23.30g。
请回答下列问题:
(1)实验Ⅱ中产生气体的电子式 。
(2)该物质的化学式为 ,下列有关该物质的用途合理的是 。
| A.补血剂 | B.净水剂 | C.含酚废水的检测试剂 | D.肥料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学小组在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,其工艺流程如下。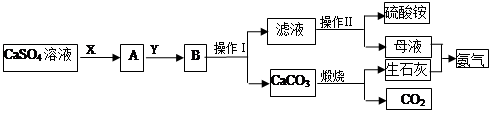
回答下列问题:
(1)操作Ⅰ的名称为_________;操作Ⅱ一系列操作包括蒸发浓缩、________、过滤。
(2)实验室中煅烧碳酸钙时,盛放碳酸钙所用的仪器是________(填名称)。
(3)X物质为____(填化学式,下同),Y物质为____,可循环利用的物质的有_____。
(4)要测定所制得的硫酸铵纯度,取10.0g样品,完全溶于水,向溶液中滴加过量的氯化钡溶液,过滤、洗涤、干燥后称量固体的质量为16.31g。为避免引起误差,检验氯化钡溶液是否过量最好的试剂是_______,所制得硫酸铵的纯度为________。
(5)下列装置不能用于实验室制氨气的是__________(填序号)。
选择氨气的制取装置后,再用下列装置收集干燥的氨气,并制取硫酸铵溶液,连接的顺序(用接口序号字母表示)是:a接____,____接____,____接_____,____接_____。
上述装置中CCl4的作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组对还原铁粉与水蒸气的反应产物进行科学探究。已知Ca(OH)2的分解温度为580℃,铁粉与水蒸气反应的温度为900℃:根据下图所示实验装置,进行了还原铁粉与水蒸气的反应实验,实验中观察到肥皂液中产生了大量的气泡。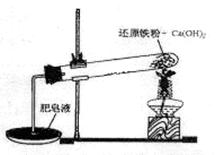
(1)实验中Ca(OH)2的作用是 。实验中产生的气体产物是 。
(2)为进一步探究还原铁粉与水蒸气反应固体产物的成分,研究性学习小组将反应后的固体经处理后得到黑色氧化物固体,针对黑色氧化物固体,该小组提出如下的假设并进行了相关的实验:
假设一:固体为FeO
假设二:固体为Fe3O4
假设三:
①限选用下列试剂:盐酸、KSCN溶液、K3Fe(CN)6 溶液、氯水,证明假设一不成立
| 操作 | 现象 | 结论 |
| | | 假设一不成立 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体生成。有人提出:CO2、SO2与过氧化钙的反应原理相同结果有O2生成;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同无O2生成。 据此设计如下实验操作进行判断。
实验一、通过气体体积的测量判断发生的化学反应,实验装置如下:
(1)请写出b的仪器名称 。
(2)试剂A可以选用 ,试剂B的作用是 。
(3)检查装置A的气密性的操作方法是 。
实验二、向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(4)提出假设:
假设1:反应后固体中只有Na2SO3,SO2未氧化;
则写出反应的化学方程式: 。
假设2:反应后固体中只有 ,SO2完全氧化;
则写出反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用少量的溴水和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: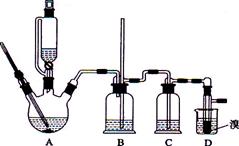
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g· cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
| 实验操作 | 预期实验现象和结论 |
| | 若____________________,假设一成立; 若____________________,假设二成立; 若____________________,假设三成立。 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
肉桂酸用途广泛,常被用作食品保鲜剂、食品添加剂、有机合成中间体等。其一种合成原理如下:
【实验步骤】
①向A中依次加入沸石、一定比例的苯甲醛、乙酸酐及少许碳酸钾。
②控制温度1500C~1700C,使其充分反应。
③向冷却后的三口瓶内加入饱和碳酸钠溶液,调节pH至9~10。
④如装置B所示,用水蒸气蒸馏,除去未反应的苯甲醛。
⑤加入活性炭,充分振荡并煮沸脱色。
⑥……
(1)装置A中冷凝管由 端(填“a”或“b”)通入冷凝水。
(2)步骤③中加入饱和碳酸钠溶液将肉桂酸、醋酸转化为肉桂酸钠和醋酸钠的原因: 。
(3)装置B在进行水蒸气蒸馏之前,需进行的操作为 ,玻璃管的作用为 。
(4)当观察到冷凝管中 ,说明水蒸气蒸馏结束。
(5)步骤⑥通过以下操作分离、提纯得较纯净的肉桂酸(难溶于水),其正确的操作顺序是 (填字母)。
a.重结晶 b.冷却、抽滤,水洗晶体
c.加入浓盐酸调节pH=3 d.静置,趁热过滤得肉桂酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl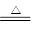 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:___________________________________。
(2)E装置的作用是_______________________________________________。
如果拆去B装置,可能的后果是______________________________________
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:__________________________________________________________;
实验室保存三氯化硼的注意事项是_________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com