
【题目】2018年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-A kJ·mol-1
②2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+ B kJ·mol-1
③2H2O(g)=2H2O(l) ΔH=-C kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g),CO2(g)和H2O(l)的热化学方程式__________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
物质 浓度(mol/L)时间(min) | NO | N2 | CO2 |
0 | 0.0100 | 0 | 0 |
10 | 0.0058 | 0.0021 | 0.0021 |
20 | 0.0040 | 0.0030 | 0.0030 |
30 | 0.0040 | 0.030 | 0.0030 |
40 | 0.0032 | 0.0034 | 0.0017 |
50 | 0.0032 | 0.0034 | 0.0017 |
①下列说法能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量
B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变
D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②压强平衡常数Kp,仅适用于气相平衡,以分压表示各成分的浓度,分压PA=P总 X nA%在T0C时,平衡总压为P,该反应的压强平衡常数的计算式为______________;
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
【答案】 2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(l) ΔH=-A-B-2C kJ·mol-1 ADEF Kp=(0.03P×0.03P)/(0.04P)2 减小CO2浓度(其它合理答案也得分) 正向移动
【解析】(1)根据盖斯定律:①-②+③×2即得到该反应的热化学方程式。
(2)①A.活性炭是固体,质量不在减小时,反应达到平衡状态;B.反应速率之比等于化学方程式系数之比;C.该反应是气体体积不变的反应,反应过程中压强始终保持不变;D.反应后气体的质量增加,容器的体积不变,混合气体的密度保持不变,反应达到平衡状态;E.反应后气体的质量增加,根据M=m/V可以判断混合气体的平均相对分子质量保持不变,反应达到平衡状态;F.容器内CO2的浓度保持不变,CO2的量保持不变,反应达到平衡状态。
②20-30min反应达到平衡状态,根据各物质的平衡浓度,计算出各物质的物质的量的百分含量,再根据平衡常数公式进行计算。
③根据图表中数据氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以改变的条件为:减小二氧化碳浓度;
④计算出在30 min时,计算出反应的平衡常数,在温度不变的条件下,计算出改变条件的浓度商,进行比较,判断反应进行的方向。
(1)根据盖斯定律可知,①-②+③×2即得到2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(l) ΔH=-A-B-2C kJ·mol-1 ;正确答案:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(l) ΔH=-A-B-2C kJ·mol-1 。
(2)①A.活性炭是固体反应物,消耗时,质量减小,当反应达平衡时,质量不变,反应达到平衡状态,正确;B.反应速率之比等于化学方程式系数之比,只有满足2v 正(N2) = 2v逆 (NO)时,反应达到平衡,B错误;C.该反应是气体体积不变的反应,反应过程中和反应平衡时压强相同,所以容器内压强保持不变不能说明反应达到平衡,C错误;混合气体密度等于质量除以体积,反应中碳是固体,只要平衡移动,气体质量一定发生变化,又因为体积不变,所以混合气体的密度保持不变,说明反应达到平衡,D正确;混合气体的平均相对分子质量等于气体总质量除以总物质的量,反应中碳是固体,只要平衡移动,气体质量一定发生变化,又因为气体物质的量不变,所以混合气体的平均相对分子质量保持不变,说明反应达到平衡状态,E正确;容积不变,可逆反应达到平衡,气体反应物和生成物的浓度一定发生不再发生变化,F正确;正确选项ADEF。
②20-30min反应达到平衡状态,根据各物质的平衡浓度c(N0)=0.004mol/L ,c(N2)=0.003 mol/L , c(CO2)= 0.003 mol/L ;反应达平衡时,N0的物质量分数为0.004/(0.004+0.003+ 0.003)=0.04;N2的物质量分数为0.003/(0.004+0.003+ 0.003)=0.03;CO2的物质量分数为0.003/(0.004+0.003+ 0.003)=0.03;该反应的压强平衡常数的计算式为Kp=(0.03P×0.03P)/(0.04P)2;正确答案:(0.03P×0.03P)/(0.04P)2。
③化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以改变的条件为:减小二氧化碳浓度;正确答案:减小CO2浓度。
④在30 min时,若只改变某一条件,反应重新达到平衡,各物质的平衡浓度为:c(N0)=0.0032mol/L,c(N2)=0.0034mol/L,c(CO2)= 0.0017mol/L;平衡常数K= c(CO2)×c(N2)/ c2(N0)= 0.0034×0.0017/(0.0032)2=0.56;其它条件不变,再充入NO和N2,使二者的浓度均增加至原来的两倍,则c(N0)=0.0064 mol/L,c(N2)=0.0068 mol/L,根据浓度商QC= c(CO2)×c(N2)/ c2(N0)= 0.0017×0.0068/(0.0064)2=0.28< K=0.56,平衡右移;正确答案:正向移动。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g. 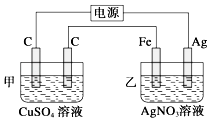
(1)经分析知,甲池是(填“原电池”或“电解池”);乙池中,银电极为极(填“阳极”或“阴极”或“正极”或“负极”).
(2)乙池中银电极的电极方程式为 , 根据题目所示数据,电路中转移了mol 电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答:
(1)近年来,我国高铁迅猛发展,为人们的出行带来便利.人们利用如下反应焊接铁轨: 8Al+3Fe3O4 ![]() 4Al2O3+9Fe.该反应是(填“放热”或“吸热”)反应,反应中的还原剂是(填化学式).
4Al2O3+9Fe.该反应是(填“放热”或“吸热”)反应,反应中的还原剂是(填化学式).
(2)钠元素有NaCl、Na2O2、NaHCO3、Na2SiO3等多种重要的化合物.请根据题意选择钠的化合物的化学式填空:其中常用来作为潜水艇和呼吸面具中氧气来源的淡黄色固体是 , 常用来烘制糕点,也可用作抗酸药的是 .
(3)向FeCl2溶液中通入Cl2 , 反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣ . 向所得溶液中滴加KSCN溶液,溶液变成色,我们可以利用这一现象检验Fe3+的存在.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L 恒容密闭容器中,发生反应:X(g)+Y(g)═2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率ν(Z)=2.0×10﹣5 mol/(Lmin)
B.4min时,ν(逆)>ν(正)
C.该温度下,此反应的平衡常数K=1.44
D.7min时,反应还未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量 变化如图(其中I代表H2A,Ⅱ代表HA﹣ , Ⅲ代表A2﹣).根据图示判断,下列说法正确的是( ) 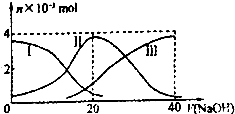
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系 c(Na+)>c(HA﹣)>c(H+)>c(A2﹣)>c(OH﹣)
B.等体积等浓度的NaOH溶液与H2A溶液混合后其溶液中水的电离程度比纯水大
C.欲使NaHA溶液呈中性,可以向其中加入酸或碱
D.向NaHA溶液加人水的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医生常给脱水病人注射0.9%的生理盐水,而不注射蒸馏水或浓度更高的浓盐水。这是因为
A. 水分子容易进出细跑
B. 无机盐离子容易进出细胞
C. 过多或过少都对红细胞有害
D. 无机盐对维持细胞的形态和生理功能有重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 稀硫酸和氢氧化钡溶液反应: H++SO42-+Ba2++OH-=BaSO4↓+H2O
B. 氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. NaOH溶液中通入过量CO2:OH-+CO2 = HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com