
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
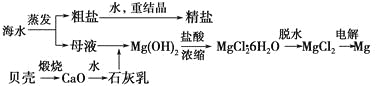
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
科目:高中化学 来源: 题型:
【题目】呋喃甲酸俗称糠酸,广泛应用于塑料工业、食品行业、涂料、医药、香料等。用呋喃甲醛制备呋喃甲酸和副产品呋喃甲醇的原理为:
反应1:![]() +NaOH
+NaOH![]()
![]() △H<0
△H<0
反应2:![]() +HCl
+HCl![]()
![]() +HCl
+HCl
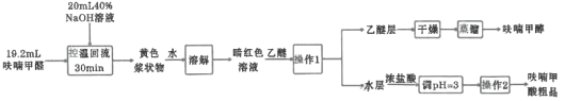
某研究性学习小组利用上图装置制备呋喃甲酸的实验流程如下:
已知:①乙醚(![]() )沸点34.6℃,其蒸气有毒,可使人失去知觉。
)沸点34.6℃,其蒸气有毒,可使人失去知觉。
②主要试剂相关物理性质如下:
试剂 | 相对分子质量 | 密度/ | 熔点/℃ | 沸点/℃ | 溶解性 |
呋喃甲醛 | 96 | 1.16 |
| 161.7 | 微溶于水,易溶于乙醇、乙醚。 |
呋喃甲醇 | 98 | 1.13 |
| 171.0 | 溶于水,可混溶于乙醇、乙醚。 |
呋喃甲酸 | 112 | - | 129.5 | 231.0 | 微溶于冷水,在热水中溶解度较大,易溶于乙醇、乙醚。 |
请回答下列问题:
(1)“控温回流”时需控制反应温度8~12℃,应采取的控温方式是________,三颈烧瓶中所加入的![]() 溶液应如何预处理________,滴加呋喃甲醛时需________。
溶液应如何预处理________,滴加呋喃甲醛时需________。
(2)在“控温回流”时充分搅拌才能获得较高产率。其原因是________。
(3)“操作1”的名称为________,所用到的玻璃仪器主要有________,“操作2”主要包括________、________。
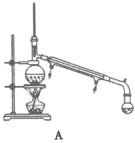
(4)“蒸馏”时,用下图________(填字母标号)装置更好,与另一装置相比,该装置的优点有①________;②________。
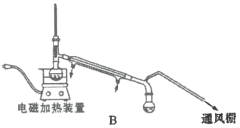
(5)呋喃甲酸粗品精制所采用的方法是________,最终得到精产品9.86g,呋喃甲酸的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(![]() )俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
)俗称草酸,在实验研究和化学工业中应用广泛。完成下列填空:
(1)室温下,测得![]() 溶液的
溶液的![]() ,写出草酸的电离方程式______。
,写出草酸的电离方程式______。
(2)草酸溶液中微粒的物质的量分数随溶液![]() 变化如图所示:
变化如图所示:
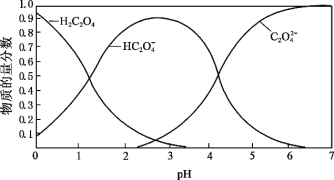
i.向草酸溶液中滴加![]() 溶液至
溶液至![]() 时发生的主要反应的离子方程式是:_______。
时发生的主要反应的离子方程式是:_______。
ii.继续加入![]() ,调节
,调节![]() 由2.5直至大于6.5,调节过程中
由2.5直至大于6.5,调节过程中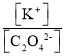 比值将________(选填“增大”、“减小”或“不变”)。
比值将________(选填“增大”、“减小”或“不变”)。
(3)工业上制取草酸的原理为:![]()
该反应的平衡常数表达式![]() _______,下列能说明反应已经达到平衡的是______。
_______,下列能说明反应已经达到平衡的是______。
a 平衡常数K保持不变 b 反应液的pH保持不变
c 丁醇的浓度保持不变 d 反应液的总质量保持不变
(4)草酸可用于测定高锰酸钾的质量分数,原理如下:![]()
i.一定条件下,测得上述反应中溶液中![]() 的浓度随反应时间的变化如图,以
的浓度随反应时间的变化如图,以![]() 浓度的变化表示此反应
浓度的变化表示此反应![]() 内的平均反应速率为____________
内的平均反应速率为____________![]()
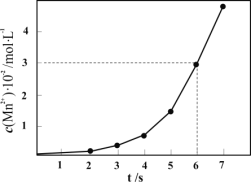
ii.分析![]() 的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
的浓度随反应时间的变化的可能原因(反应过程中温度没有明显变化)_____。
(5)取![]() 的高锰酸钾产品,配成
的高锰酸钾产品,配成![]() 溶液,取出
溶液,取出![]() ,消耗
,消耗![]() 草酸标准溶液
草酸标准溶液![]() ,则样品中高锰酸钾的质量分数为______。
,则样品中高锰酸钾的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、已知下面在298K时的热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O (l) ΔH=-890.3 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1。根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是___。
(2)根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___。
(3)已知H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:___。
Ⅱ、为了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
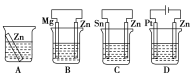
(1)分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是___。
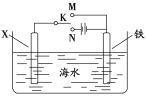
(2)利用如图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:
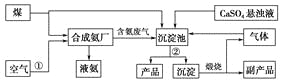
请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是重要的气体燃料和化工原料。回答下列问题:
(1)已知![]() 、
、![]() 、
、![]() 的燃烧热分别为
的燃烧热分别为![]() ,
,![]() ,
,![]() 。利用甲烷制备合成气的反应为
。利用甲烷制备合成气的反应为![]()
![]() 。
。
根据上述数据能否计算![]() ________(填“能”或“否”),理由是________________。
________(填“能”或“否”),理由是________________。
(2)在某密闭容器中通入![]()
![]() 和
和![]() ,在不同条件下发生反应:
,在不同条件下发生反应:
![]()
![]()
测得平衡时![]() 的体积分数与温度、压强的关系如图所示。
的体积分数与温度、压强的关系如图所示。
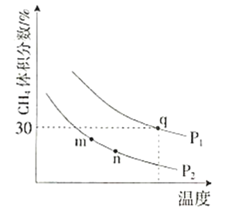
①![]() ________
________![]() ,
,![]() ________(填“<”、“>”或“=”)。
________(填“<”、“>”或“=”)。
②m、n、q三点的化学平衡常数大小关系为________。
③q点甲烷的转化率为________,该条件下的化学平衡常数![]() ________(用含有
________(用含有![]() 的表达式表示,
的表达式表示,![]() 为以分压表示的平衡常数)。
为以分压表示的平衡常数)。
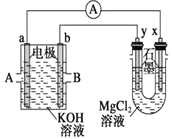
(3)用甲烷和![]() 构成的燃料电池电解
构成的燃料电池电解![]() 溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
溶液,装置如下图所示。反应开始后,观察到x电极附近出现白色沉淀。则A处通入的气体是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请据如下实验方案回答问题。

(1)操作1的名称是_________;
(2)反应①中加入略过量的A物质的目的是_________________________;判断A已过量的实验操作方法是________________________。
(3)写出反应②的化学方程式:______________________________。如果加入盐酸过量,则对所得到的氯化钠的纯度_________(填“有”或“没有”)影响。
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g,则样品中NaCl的质量分数是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com