
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
【答案】AC
【解析】
先分析反应:CO(g)+2H2(g) ![]() CH3OH(g),气体分子数两边不等;再对比容器Ⅰ、Ⅱ,体积相等,均从反应物开始,Ⅱ中H2浓度是Ⅰ中H2的一半,平衡后Ⅱ中H2浓度也是Ⅰ中H2的一半,如果a=1, 则Ⅰ相当于在与Ⅱ等效的基础上加压,平衡偏向正向,平衡时H2的物质的量浓度小于1molL-1,所以a应小于1。根据Ⅱ的平衡可计算出T1时的平衡常数:
CH3OH(g),气体分子数两边不等;再对比容器Ⅰ、Ⅱ,体积相等,均从反应物开始,Ⅱ中H2浓度是Ⅰ中H2的一半,平衡后Ⅱ中H2浓度也是Ⅰ中H2的一半,如果a=1, 则Ⅰ相当于在与Ⅱ等效的基础上加压,平衡偏向正向,平衡时H2的物质的量浓度小于1molL-1,所以a应小于1。根据Ⅱ的平衡可计算出T1时的平衡常数:
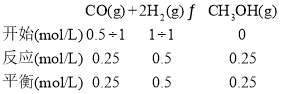
![]()
可在此基础上对各选项作出判断。
A. 0~5 min时,容器Ⅰ中v(CO)=![]() v(H2)=
v(H2)= ![]() ×
×![]() =0.1 mol·L-1·min-1,A选项正确;
=0.1 mol·L-1·min-1,A选项正确;
B. 如果a=1,则Ⅰ相当于在与Ⅱ等效的基础上加压,使得平衡时H2的物质的量浓度小于1molL-1,B选项错误;
C. 容器Ⅱ温度改变为T2(T2>T1)时,平衡常数KT2=1<KT1=4,说明升高温度反应逆向移动,则ΔH<0,C选项正确;
D. T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,此时Q=![]() =1<KT1=4,反应将向正反应方向进行,D选项错误;
=1<KT1=4,反应将向正反应方向进行,D选项错误;
答案选AC。


科目:高中化学 来源: 题型:
【题目】请写出下述过程各步的反应类型及化学方程式。
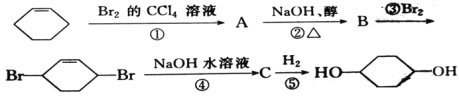
①为_____反应,化学方程式为________
②为_____反应,化学方程式为________
③为_____反应,化学方程式为________
④为_____反应,化学方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.钢铁浸泡于食盐水中发生电化学腐蚀时的正极反应为:2H2O+2e-=H2↑+2OH-
B.增大气体压强或使用催化剂能能提高活化分子的百分数,从而加快反应速率
C.反应2CO(g)=2C(s)+O2(g) ΔS<0在任何条件下都不能自发进行
D.工业上合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0采用高温是为了提高N2的平衡转化率
2NH3(g) ΔH<0采用高温是为了提高N2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。
(1)写出实验室制取氨气的化学方程式_____。
(2)工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
过程中能量变化如图所示。
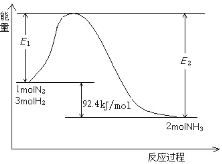
①该反应是_____反应。(填“放热”或“吸热”)
②在反应体系中加入催化剂,E2会_____。(填“增大”或“减小”或“不变”)
③若要增大NH3产率,可采取的措施有_____。(填字母)
a.升高温度 b.增大压强 c.不断分离出NH3
(3)利用如图所示装置探究NH3能否被NO2氧化。
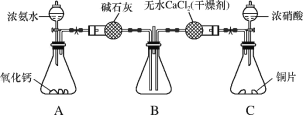
①C装置中制取NO2反应的离子方程式是_____。
②某同学认为NH3能被NO2氧化,且全部生成无毒物质,预期观察到B装置中红棕色消失。下表为不同时间下观察到的现象。
时间 | 1分钟 | 2分钟 | 3分钟 |
现象 | 红棕色未消失 | 红棕色未消失 | 红棕色未消失 |
请分析没有达到预期现象可能的原因(任写两条)_____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:
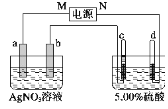
(1)直流电源中,M为_________极。
(2)Pt电极上生成的物质是_________,其质量为___________g。
(3)AgNO3溶液的浓度______填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH_________,硫酸的浓度________, 硫酸的pH_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学·选修3:物质结构与性质
氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石( Na3AlF6)等。回答下列问题:
(1)基态氟原子中有_________________种能量不同的电子。
(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3( -33° C)的沸点比NF3( -129° C)的高,原因为_____________。
(3)氟硼酸( HBF4,属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因:________。
(4)液态[H2F]+中存在[H2F]+和[HF2]- ,[HF2]-的结构可表示为[F-H…F]- ,[H2F]+的VSEPR模型名称为________形。NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160°C分解。NaHF2中所含作用力的类型有______. (填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(5)CaF2是难溶化合物,其品胞结构如图所示:
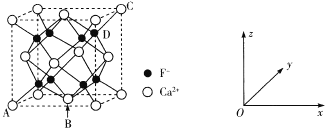
①若原子坐标参数A处为(0,0,0),B处为(![]() ,C处为(1,1,1),则D处为_____.
,C处为(1,1,1),则D处为_____.
②每个Ca2+周围距离最近的Ca2+共有_____个。
③已知:CaF2晶体密度为cg·cm-3 ,则晶胞中Ca2+与最近的F-之间的距离为____nm(设NA表示阿伏加德罗常数的值,用含c、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO、CO2均可以生产甲醇。CO在一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
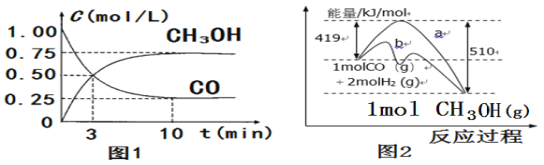
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=___;
(2)图2表示该反应进行过程中能量的变化,请根据图像写出反应的热化学方程式:___;
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH-―4e-=O2↑+2H2O,则阴极反应式为:___;
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
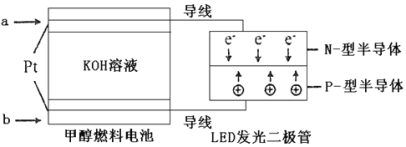
请写出加入(通入)a物质一极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:

(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 (填序号)。
A.适当减缓通入Cl2速率
B.充分搅拌浆料
C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2===Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。

①滤渣的主要成分为 (填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2] ∶n[CaCl2] 1∶5(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3,若溶液中KClO3的含量为100gL-1,从该溶液中尽可能多地析出KClO3固体的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com