
【题目】化学·选修3:物质结构与性质
氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石( Na3AlF6)等。回答下列问题:
(1)基态氟原子中有_________________种能量不同的电子。
(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3( -33° C)的沸点比NF3( -129° C)的高,原因为_____________。
(3)氟硼酸( HBF4,属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因:________。
(4)液态[H2F]+中存在[H2F]+和[HF2]- ,[HF2]-的结构可表示为[F-H…F]- ,[H2F]+的VSEPR模型名称为________形。NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160°C分解。NaHF2中所含作用力的类型有______. (填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(5)CaF2是难溶化合物,其品胞结构如图所示:
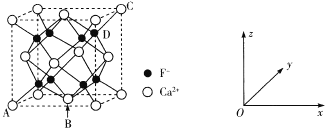
①若原子坐标参数A处为(0,0,0),B处为(![]() ,C处为(1,1,1),则D处为_____.
,C处为(1,1,1),则D处为_____.
②每个Ca2+周围距离最近的Ca2+共有_____个。
③已知:CaF2晶体密度为cg·cm-3 ,则晶胞中Ca2+与最近的F-之间的距离为____nm(设NA表示阿伏加德罗常数的值,用含c、NA的式子表示)。
【答案】3 二者均为分子晶体,但是NH3分子间能形成氢键 HF分子中F原子有孤电子对,而BF3分子中B原子有空轨道,二者可以形成配位键 四面体 abd ![]() 12
12 ![]()
【解析】
(1)基态F 原子的电子排布式为1s22s22p5,所以有3种不同能量的电子,故答案为:3;
(2)NH3与NF3均为分子晶体,NH3能形成分子间氢键,所以熔沸点更高,故答案为:二者均为分子晶体,但是NH3分子间能形成氢键;
(3)BF3分子中B原子上有空轨道,而HF分子中的F原子上有孤电子,对,当BF3与HF靠近时,HF分子中F原子的孤电子对填充BF3分子中B原子的空轨道,二者形成配位键,从而结合形成HBF4,故答案为:HF分子中F原子有孤电子对,而BF3分子中B原子有空轨道,二者可以形成配位键;
(4)[H2F]+中F的价层电子对数为![]() 4,故为sp3杂化,VSEPR模型为四面体。NaHF2 中Na+与[HF2]-之间为离子键,[F—H
4,故为sp3杂化,VSEPR模型为四面体。NaHF2 中Na+与[HF2]-之间为离子键,[F—H![]() F]-中含共价键和氢键,故答案为:四面体;abd;
F]-中含共价键和氢键,故答案为:四面体;abd;
(5)①D点在底面和侧面的投影均为面对角线的![]() 处,故坐标为
处,故坐标为![]() ;
;
②晶胞中Ca2+构成面心立方最密堆积方式,每个Ca2+周围最近的Ca2+有12个,故答案为:12;
③根据均摊法可知,1个氟化钙晶胞中有4个F-,![]() =4Ca2+;设晶胞中棱长为acm;氟化钙的式量为78;,根据密度计算公式
=4Ca2+;设晶胞中棱长为acm;氟化钙的式量为78;,根据密度计算公式![]() ,所以a=
,所以a=![]() ,从晶胞结构可以看出,与Ca2+最近的F-距离为
,从晶胞结构可以看出,与Ca2+最近的F-距离为![]() a,即
a,即![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】符合分子式“C6H6”的多种可能结构如图所示,下列说法正确的是

A. 1~5对应的结构中能使溴的四氯化碳溶液褪色的有4个
B. 1~5对应的结构中一氯取代物只有1种的有3个
C. 1~5对应的结构中所有原子均可能处于同一平面的有1个
D. 1~5对应的结构均能与氢气在一定条件下发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,两体积均为1 L的容器中发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
CH3OH(g) ΔH。容器中起始各物质的物质的量如下表所示,两容器中c(H2)随时间t的变化如下图所示。
容器 | 温度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列说法正确的是
A.0~5 min时,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ温度改变为T2(T2>T1)时,平衡常数K=1,则ΔH<0
D.T1℃时,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是A~G七种元素的电子排布:
元素 电子排布 电子层 | A | B | C | D | E | F | G |
K | 1 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 4 | 5 | 6 | 8 | 8 | 8 | |
M | 1 | 3 | 7 |
试根据由上述元素构成的物质的化学式回答下列问题。
(1)写出一种常见的由非极性键形成的双原子分子:____________________。
(2)写出一种由极性键形成的双原子分子:____________________。
(3)写出一种由极性键形成的三原子分子:____________________。
(4)写出一种由三种元素形成的既含离子键又含共价键的化合物:__________,其电子式为____________________。
(5)写出一种既含离子键又含非极性键的化合物:__________,其电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.4.0g由CO2和SO2组成的混合物中含有的质子数为2NA
B.1L0.5mol/LpH=7的CH3COONH4溶液中NH4+数目为0.5NA
C.常温下,0.1mol环氧乙烷(![]() )中含有的共价键数目为0.3NA
)中含有的共价键数目为0.3NA
D.22.4LCO2与足量Na2O2充分反应,转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】倍他乐克是一种治疗高血压的药物,其中间体F合成路线如下:

回答下列问题:
(1)A的分子式为____ 。 D中官能团的名称是____ 。
(2)B与足量NaOH溶液反应的化学方程式为____。
(3)D→E的反应类型为_____。
(4)反应⑤加入试剂X反应后只生成中间体F,则X结构简式为 ___。
(5)满足下列条件的C的同分异构体有_____种。
①能发生银镜反应;
②与NaOH溶液反应时,1molC最多消耗3molNaOH;
③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位。其中核磁共振氢谱有4种不同化学环境的氢,且峰面积比为1︰6︰2︰1的可能是____(写结构简式)。
(6)根据已有知识及题目相关信息,完成以 和CH3OH、CH3ONa为原料制备
和CH3OH、CH3ONa为原料制备 的合成路线流程图(无机试剂任选)____。
的合成路线流程图(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
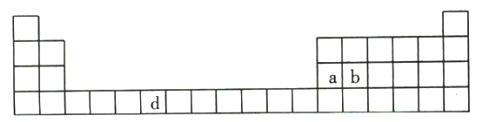
(1)请写出元素d的基态原子的电子排布式: _______________________________________。
(2)b的氧化物中b原子与氧原子之间的共价键类型是__________________________其中b原子的杂化方式是____________________________________________。
(3)a的单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。
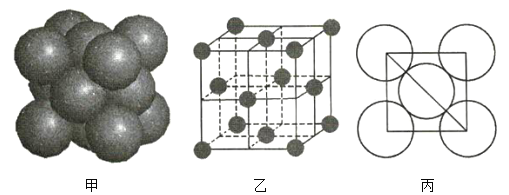
若已知a元素原子的半径为d,NA代表阿伏加德罗常数,a元素原子的摩尔质量为M,则1个晶胞中a原子的数目为____________________________,该晶体的密度为____________________________________(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com