
【题目】倍他乐克是一种治疗高血压的药物,其中间体F合成路线如下:

回答下列问题:
(1)A的分子式为____ 。 D中官能团的名称是____ 。
(2)B与足量NaOH溶液反应的化学方程式为____。
(3)D→E的反应类型为_____。
(4)反应⑤加入试剂X反应后只生成中间体F,则X结构简式为 ___。
(5)满足下列条件的C的同分异构体有_____种。
①能发生银镜反应;
②与NaOH溶液反应时,1molC最多消耗3molNaOH;
③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位。其中核磁共振氢谱有4种不同化学环境的氢,且峰面积比为1︰6︰2︰1的可能是____(写结构简式)。
(6)根据已有知识及题目相关信息,完成以 和CH3OH、CH3ONa为原料制备
和CH3OH、CH3ONa为原料制备 的合成路线流程图(无机试剂任选)____。
的合成路线流程图(无机试剂任选)____。
【答案】C8H8O2 羟基、醚键  +2NaOH
+2NaOH![]()
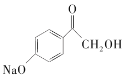 +NaBr+H2O 取代反应 (CH3)2CHNH2 7
+NaBr+H2O 取代反应 (CH3)2CHNH2 7  和
和
【解析】
(1)根据A的键线式可知其分子式;由结构可知D中的官能团;
(2)B中含有酚羟基和溴原子,都可以与NaOH反应;
(3)根据D、E物质的结构简式,分析反应特点;
(4)根据EF的结构简式,分析反应的特点和规律,找出X的结构简式;
(5)C的分子式为C9H10O3,同分异构体满足:①能发生银镜反应,说明含有-CHO;②与NaOH溶液反应时,1molC最多消耗3molNaOH,而只含有3个O原子,说明分子中含有酚羟基,但由于含有-CHO,所以不可能有三个羟基,则只能是含有酯基,酯基水解生成甲酸和酚羟基;③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位,根据分子式可知4个取代基分别为-OOCH,-OH和两个-CH3,两个甲基处于间位,据以上分析写出同分异构体的结构简式;
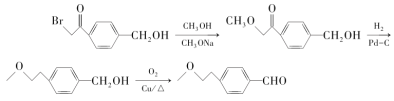
(6)观察原料和目标产物可知,羟基被氧化,苯环上另一个取代基发生类似B到D的变化,据此写出合成路线。
(1)根据A的键线式可知其分子式为C8H8O2;根据D的结构简式可知其官能团为羟基、醚键;
(2)B中含有酚羟基和溴原子,都可以与NaOH反应,方程式为: +2NaOH
+2NaOH![]()
 +NaBr+H2O;
+NaBr+H2O;
(3)D到E的转化过程中D中酚羟基上的氢原子被取代,为取代反应;
(4)反应⑤加入试剂X反应后只生成中间体F,该过程中环打开,开环后两端O原子连接一个氢原子,另一端碳原子连接(CH3)2CHNH-,所以X为(CH3)2CHNH2;
(5)C的分子式为C9H10O3,同分异构体满足:
①能发生银镜反应,说明含有-CHO;
②与NaOH溶液反应时,1molC最多消耗3molNaOH,而只含有3个O原子,说明分子中含有酚羟基,但由于含有-CHO,所以不可能有三个羟基,则只能是含有酯基,酯基水解生成甲酸和酚羟基;
③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位,根据分子式可知4个取代基分别为-OOCH,-OH和两个-CH3,两个甲基处于间位,满足条件的同分异构体有: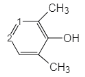 、
、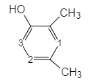 、
、 (数字表示-OOCH的位置),共有2+3+2=7种,峰面积比为1︰6︰2︰1的为:
(数字表示-OOCH的位置),共有2+3+2=7种,峰面积比为1︰6︰2︰1的为: 和
和 ;
;
(6)观察原料和目标产物可知,羟基被氧化,苯环上另一个取代基发生类似B到D的变化,所以合成路线为: 。
。


科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1 molCH4转移12 mol电子
3H2+CO,每消耗1 molCH4转移12 mol电子
B. 电极B上发生的电极反应:O2+2CO2+4e-=2CO32-
C. 电池工作时,CO32-向电极B移动
D. 电极A上H2参与的电极反应:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业及制造硝酸的原料。
(1)写出实验室制取氨气的化学方程式_____。
(2)工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
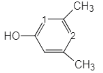
过程中能量变化如图所示。
①该反应是_____反应。(填“放热”或“吸热”)
②在反应体系中加入催化剂,E2会_____。(填“增大”或“减小”或“不变”)
③若要增大NH3产率,可采取的措施有_____。(填字母)
a.升高温度 b.增大压强 c.不断分离出NH3
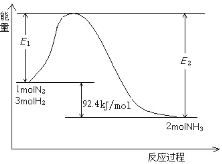
(3)利用如图所示装置探究NH3能否被NO2氧化。
①C装置中制取NO2反应的离子方程式是_____。
②某同学认为NH3能被NO2氧化,且全部生成无毒物质,预期观察到B装置中红棕色消失。下表为不同时间下观察到的现象。
时间 | 1分钟 | 2分钟 | 3分钟 |
现象 | 红棕色未消失 | 红棕色未消失 | 红棕色未消失 |
请分析没有达到预期现象可能的原因(任写两条)_____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学·选修3:物质结构与性质
氟及其化合物用途非常广泛,自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石( Na3AlF6)等。回答下列问题:
(1)基态氟原子中有_________________种能量不同的电子。
(2)NF3是微电子工业中优良的等离子刻蚀气体。NF3与NH3的空间构型相同,但是NH3( -33° C)的沸点比NF3( -129° C)的高,原因为_____________。
(3)氟硼酸( HBF4,属于强酸)常用于替代浓硫酸作铅蓄电池的电解质溶液,可由HF和BF3合成,从化学键形成角度分析HF与BF3能化合的原因:________。
(4)液态[H2F]+中存在[H2F]+和[HF2]- ,[HF2]-的结构可表示为[F-H…F]- ,[H2F]+的VSEPR模型名称为________形。NaHF2可用于制无水氟化氢和供雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160°C分解。NaHF2中所含作用力的类型有______. (填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
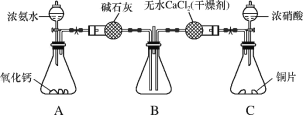
(5)CaF2是难溶化合物,其品胞结构如图所示:
①若原子坐标参数A处为(0,0,0),B处为(![]() ,C处为(1,1,1),则D处为_____.
,C处为(1,1,1),则D处为_____.
②每个Ca2+周围距离最近的Ca2+共有_____个。
③已知:CaF2晶体密度为cg·cm-3 ,则晶胞中Ca2+与最近的F-之间的距离为____nm(设NA表示阿伏加德罗常数的值,用含c、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用电解NaB(OH)4溶液制备H3BO3的工作原理如下图。 下列说法中正确的是
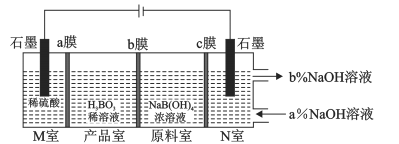
A.b膜为阳离子交换膜
B.N室中,进口和出口NaOH溶液的浓度:a%<b%
C.电子从左边石墨电极流出,先后经过a、b、c膜流向右边石墨电极
D.理论上每生成1molH3BO3,两极室共生成33.6L气体(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO、CO2均可以生产甲醇。CO在一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
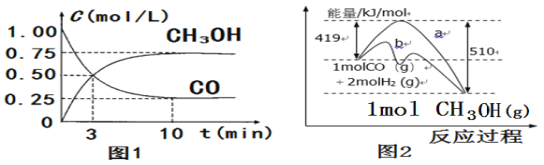
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=___;
(2)图2表示该反应进行过程中能量的变化,请根据图像写出反应的热化学方程式:___;
(3)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH-―4e-=O2↑+2H2O,则阴极反应式为:___;
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
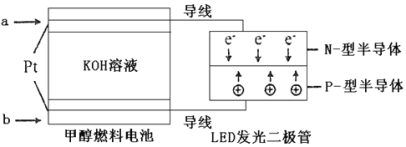
请写出加入(通入)a物质一极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的核磁共振氢谱如图M1-1所示,下列说法中,错误的是
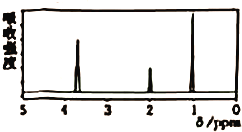
A. 若A的分子式为![]() ,则其结构简式为
,则其结构简式为![]()
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为![]() ,则其同分异构体有3种
,则其同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S与O可形成![]() 。
。
(1)![]() 的空间构型为_____________________。
的空间构型为_____________________。
(2)写出一种与![]() 互为等电子体的分子的化学式:____________________。
互为等电子体的分子的化学式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌(ZnO)广泛用于橡胶、涂料、陶瓷、电子等行业,以粗氧化锌(主要成分为ZnO,还含有少量MnO、CuO、FeO、Fe2O3等)为原料经深度净化可制备高纯活性氧化锌,其流程如图所示:
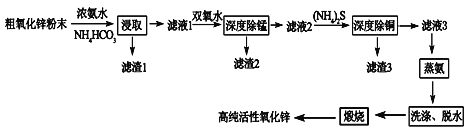
几种难溶物的Ksp:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 1.9×10-13 | 8.0×10-16 | 4.0×10-38 | 2.5×10-22 | 6.4×10-36 |
(1)将大小为66nm的高纯活性氧化锌粉末分散到水中,所得分散系为______。
(2)“浸取”过程中ZnO与NH3·H2O、NH4HCO3反应生成可溶性的Zn[(NH3)n]CO3和H2O。若有1mol ZnO溶解,则在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值为___________(已知:1≤n≤4)。
(3)“深度除锰”过程中双氧水可将“滤液1”中的Mn(OH)2转化为更难溶的MnO2·H2O,写出反应的化学方程式______________,“滤渣2”中存在的物质除了MnO2·H2O还可能含有_________(用化学式表示)。
(4)“深度除铜”过程中当溶液中![]() ≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
(5)“蒸氨”过程中Zn[(NH3)n]CO3分解为ZnCO3·2Zn(OH)2·H2O、NH3和CO2。为了提高经济效益,请设计循环利用NH3和CO2方案_____________。
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,写出反应的化学方程式______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com