
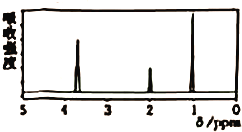
【题目】已知某有机物A的核磁共振氢谱如图M1-1所示,下列说法中,错误的是
A. 若A的分子式为![]() ,则其结构简式为
,则其结构简式为![]()
B. 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3
C. 仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为![]() ,则其同分异构体有3种
,则其同分异构体有3种
【答案】A
【解析】
核磁共振氢谱中有几个峰就有几种H原子,峰的面积之比等于H原子数目之比,有机物C3H6O2的核磁共振氢谱有三个信号峰,其强度比为3:2:1,分子中有3种化学环境不同的H原子,且H原子数目依次为3、2、1,据此解题。
A.核磁共振氢谱中有3个峰,有3种H原子,而CH3COOCH3只有2种H原子,故A错误;
B.核磁共振氢谱中有几个峰就有几种H原子,峰的面积之比等于H原子数目之比,该有机物分子中有三种不同化学环境的氢原子,且个数之比为1:2:3,故B正确;
C.核磁共振氢谱能确定氢原子的种类,仅由其核磁共振氢谱无法得知其分子中的氢原子总数,故C正确;
D.由有机物A的核磁共振氢谱可知,有机物A有3种化学环境不同的H原子,且不同化学环境的H原子数目为3、2、1,可能结构有:CH3CH2COOH、HCOOCH2CH3、CH3COCH2OH,故D正确。
故选A。


科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A.Y的核外电子排布式为![]()
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是A~G七种元素的电子排布:
元素 电子排布 电子层 | A | B | C | D | E | F | G |
K | 1 | 2 | 2 | 2 | 2 | 2 | 2 |
L | 4 | 5 | 6 | 8 | 8 | 8 | |
M | 1 | 3 | 7 |
试根据由上述元素构成的物质的化学式回答下列问题。
(1)写出一种常见的由非极性键形成的双原子分子:____________________。
(2)写出一种由极性键形成的双原子分子:____________________。
(3)写出一种由极性键形成的三原子分子:____________________。
(4)写出一种由三种元素形成的既含离子键又含共价键的化合物:__________,其电子式为____________________。
(5)写出一种既含离子键又含非极性键的化合物:__________,其电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】倍他乐克是一种治疗高血压的药物,其中间体F合成路线如下:

回答下列问题:
(1)A的分子式为____ 。 D中官能团的名称是____ 。
(2)B与足量NaOH溶液反应的化学方程式为____。
(3)D→E的反应类型为_____。
(4)反应⑤加入试剂X反应后只生成中间体F,则X结构简式为 ___。
(5)满足下列条件的C的同分异构体有_____种。
①能发生银镜反应;
②与NaOH溶液反应时,1molC最多消耗3molNaOH;
③苯环上只有4个取代基,且直接与苯环相连的烃基处于间位。其中核磁共振氢谱有4种不同化学环境的氢,且峰面积比为1︰6︰2︰1的可能是____(写结构简式)。
(6)根据已有知识及题目相关信息,完成以 和CH3OH、CH3ONa为原料制备
和CH3OH、CH3ONa为原料制备 的合成路线流程图(无机试剂任选)____。
的合成路线流程图(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家认为,氢气是21世纪一种高效而无污染的理想能源。
(1)为了有效发展氢能源,首先必须制得廉价的氢气,下列可供开发较经济且资源可持续利用的制氢气的方法是___。
A.电解水 B.锌和稀硫酸反应 C.催化光解海水 D.分解天然气
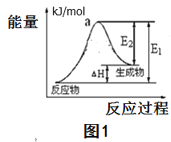
(2)用水分解获得氢气的能量变化如图1所示,则此反应的焓变△H=___kJ/mol。(请用关于E1,E2的代数式表示)。
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol﹣1
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol﹣1
则CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=___kJmol﹣1
(4)某固体酸膜氢氧燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图2所示,请按要求回答下列问题:
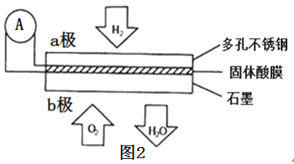
①b极上的电极反应式为___。
②此电池工作时每消耗4.48L(标准状况下)H2,转移电子___mol。
③若将这些电子用于铅蓄电池(两极板上分别覆盖有Pb、PbO2,电解质溶液是H2SO4溶液)充电,铅蓄电池中产生H2SO4的物质的量为___mol,铅蓄电池阳极发生的反应为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物P的结构片段如图所示。下列说法不正确的是(图中![]() 表示链延长)
表示链延长)

A. 聚合物P中有酯基,能水解
B. 聚合物P的合成反应为缩聚反应
C. 聚合物P的原料之一丙三醇可由油脂水解获得
D. 邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是![]()
![]()
A. CS2是V形分子 B. SnBr2键角大于![]()
C. BF3是三角锥形分子 D. NH4+键角等于10928ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜三种金属元素在日常生活中的应用最为广泛。回答下列问题:
(1)基态Fe原子的简化电子排布式为__________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式_________;Fe(CO)5分子中σ键与π键之比为_______。
(3)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_______。NO3-中心原子的轨道杂化类型为________。
②与NH3互为等电子体的一种阴离子为_______(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因________。
(4)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
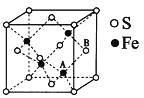
(5)铁和硫形成的某种晶胞结构如图所示,晶胞参数a=xpm,则该物质的化学式为_______;A原子距离B原子所在立方体侧面的最短距离为______pm(用x表示);该晶胞的密度为____g·cm-3。(阿伏加德罗常数用NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com