
| A. | 用烧碱溶液消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH═NaNO2+H2O | |
| B. | 制硝酸铜:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | |
| C. | 制甲基丙烯酸甲酯(即有机玻璃): | |
| D. | 制硫酸铜:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,CuO+H2SO4(稀)═CuSO4+H2O |
分析 A.二氧化氮、一氧化氮都有毒,能够引起空气污染;
B.此法制备硝酸铜生成一氧化氮,一氧化氮有毒;
C.此法制备有机玻璃原子利用率100%;
D.由此法制取硫酸铜,无污染性气体生成.
解答 解:A.烧碱溶液消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH═NaNO2+H2O,能够减少空气污染,故A正确;
B.制硝酸铜:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,反应生成的一氧化氮有毒,能够引起污染空气,不符合绿色化学概念,故B错误;
C.此法制备有机玻璃原子利用率100%,符合绿色化学概念,故C正确;
D.由此法制取硫酸铜,无污染性气体生成,符合倡导的绿色化学,故C正确;
故选:B.
点评 本题考查了“绿色化学”的含义,明确绿色化学概念的内涵是解题关键,题目难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | mg钠铝合金投入足量水中,若所得溶液只含一种溶质,则其中含有钠的质量为0.46mg | |
| D. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则钠的质量分数越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.
氯化亚铜(CuCl)为白色晶体,微溶于水,能溶于氨水、浓盐酸,并生成配合物,不溶于硫酸、稀硝酸和醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液可以用于区分葡萄糖和麦芽糖 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 对苯二酚和 互为同系物 互为同系物 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图:下列关于莽草酸的说法中正确的是( )
八角、茴香中含有一种抗亚川禽流感病毒的重要成分莽草酸,它的结构简式如图:下列关于莽草酸的说法中正确的是( )| A. | 该化合物的分子中处于同一平面的原子只有4个 | |
| B. | 该化合物能发生消去反应,不能发生酯化反应 | |
| C. | 该化合物属于多元醇类物质,不能使溴水褪色 | |
| D. | 该化合物只有酸性,不具有碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
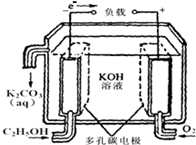 (1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);
(1)广州是一座美丽的海滨城市,海水资源非常丰富.海洋电池是以铝为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应为:4Al+3O2+6H2O═4A1(OH)3,下列说法正确的是bc(填写序号字母);查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用铜作电极电解硫酸溶液:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| C. | 等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合时发生反应:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com