
【题目】设为阿伏加德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1![]()
B.标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4![]()
C.pH=13的NaOH溶液中含有的OH-为0.1mol
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4![]()
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案
方案一 滴定法:用酸性KMnO4溶液滴定,测定铁元素的含量
(1)写出该滴定反应的离子方程式 。
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)
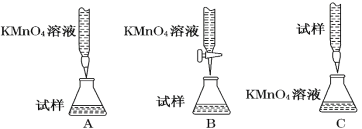
(3)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、烧杯、胶头滴管、玻璃棒外,还需 (填仪器名称)。在溶液配制过程中,下列操作会导致配制结果偏低的是___________(填写代号)。
a.定容时,俯视容量瓶刻度线
b.容量瓶在使用前内有少量蒸馏水
c.转移溶液后的烧杯、玻璃棒未洗涤
d.定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
A.浓盐酸 B.稀硫酸 C.稀硝酸 D.浓硫酸
方案二 称量法:操作流程如下:

(5)写出步骤②中H2O2氧化Fe2+ 的离子方程式 。步骤②中除用H2O2外还可以使用的物质是 ,步骤②是否可以省略 ,理由是 。
(6)步骤④一系列操作依次是:过滤、洗涤、 、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
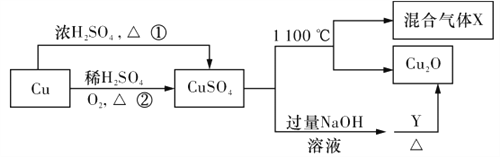
A. 相对于途径①,途径②更好地体现了绿色化学思想
B. Y可以是葡萄糖溶液
C. CuSO4在1100℃分解所得气体X是SO2和SO3的混合气体
D. 将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,其水溶液呈碱性,B是能使带火星的木条复燃的无色无味气体, G是一种红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)
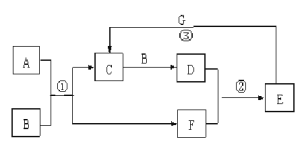
请回答下列问题:
(1)反应①的化学方程式为 。当有1molA参加反应时,转移 mol电子。
(2)反应②的化学方程式为 。
(3)反应③的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是以电解饱和食盐水为基础的基本化学工业。下图是某氯碱工业生产原理示意图:
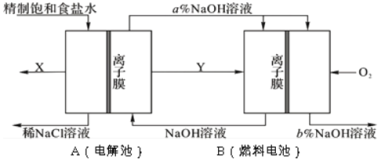
(1)写出装置A在通电条件下反应的化学方程式______________。
(2)A装置所用食盐水由粗盐水精制而成。精制时,为除去食盐水中的Mg2+和Ca2+,要加入的试剂分别为___________、___________。
(3)氯碱工业是高耗能产业,按上图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,且相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是______________(填化学式);X与稀NaOH溶液反应的离子方程式是:______________。
②分析比较图示中氢氧化钠质量分数a%与b%的大小___________。
③若用B装置作为A装置的辅助电源,每当消耗标准状况下氧气的体积为11.2 L时,则B装置可向A装置提供的电量约为______________(一个e-的电量为1.60×10-19C;计算结果精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
B.乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应
C.分馏、干馏都是物理变化,裂化、裂解都是化学变化
D.石油经过分馏得到多种烃,煤经过分馏可制得焦炭、煤焦油等产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将基态P原子的电子排布式写成1s22s22p63s23px23py1,它违背了
A. 泡利原理 B. 能量守恒原理 C. 构造原理 D. 洪特规则
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com