
ЎҫМвДҝЎҝВИјо№ӨТөКЗТФөзҪвұҘәНКіСОЛ®ОӘ»щҙЎөД»щұҫ»ҜС§№ӨТөЎЈПВНјКЗДіВИјо№ӨТөЙъІъФӯАнКҫТвНјЈә
ЈЁ1Ј©РҙіцЧ°ЦГAФЪНЁөзМхјюПВ·ҙУҰөД»ҜС§·ҪіМКҪ______________ЎЈ
ЈЁ2Ј©AЧ°ЦГЛщУГКіСОЛ®УЙҙЦСОЛ®ҫ«ЦЖ¶шіЙЎЈҫ«ЦЖКұЈ¬ОӘіэИҘКіСОЛ®ЦРөДMg2+әНCa2+Ј¬ТӘјУИлөДКФјБ·ЦұрОӘ___________Ўў___________ЎЈ
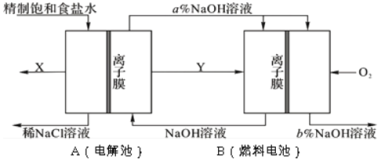
ЈЁ3Ј©ВИјо№ӨТөКЗёЯәДДЬІъТөЈ¬°ҙЙПНјҪ«өзҪвіШУлИјБПөзіШПаЧйәПөДРВ№ӨТХҝЙТФҪЪЈЁөзЈ©ДЬ30ЈҘТФЙПЈ¬ЗТПа№ШОпБПөДҙ«КдУлЧӘ»Ҝ№ШПөИзНјЛщКҫЈ¬ЖдЦРөДөзј«ОҙұкіцЈ¬ЛщУГөДАлЧУДӨ¶јЦ»ФКРнСфАлЧУНЁ№эЎЈ
ўЩНјЦРYКЗ______________ЈЁМо»ҜС§КҪЈ©Ј»XУлПЎNaOHИЬТә·ҙУҰөДАлЧУ·ҪіМКҪКЗЈә______________ЎЈ
ўЪ·ЦОцұИҪПНјКҫЦРЗвСх»ҜДЖЦКБҝ·ЦКэaЈҘУлbЈҘөДҙуРЎ___________ЎЈ
ўЫИфУГBЧ°ЦГЧчОӘAЧ°ЦГөДёЁЦъөзФҙЈ¬ГҝөұПыәДұкЧјЧҙҝцПВСхЖшөДМе»эОӘ11.2 LКұЈ¬ФтBЧ°ЦГҝЙПтAЧ°ЦГМṩөДөзБҝФјОӘ______________ЈЁТ»ёцe-өДөзБҝОӘ1.60ЎБ10-19CЈ»јЖЛгҪб№ыҫ«И·өҪ0.01Ј©ЎЈ
Ўҫҙр°ёЎҝЈЁ1Ј©2NaClЈ«2H2O![]() 2NaOHЈ«H2ЎьЈ«Cl2ЎьЈ»
2NaOHЈ«H2ЎьЈ«Cl2ЎьЈ»
ЈЁ2Ј©NaOHИЬТәЈ»Na2CO3ИЬТәЈ»
ЈЁ3Ј©ўЩH2Ј»2OH-Ј«Cl2ЈҪClO-Ј«Cl-Ј«H2OЈ»ўЪbЈҘЈҫaЈҘЈ»ўЫ1.93ЎБ105CЎЈ
ЎҫҪвОцЎҝ
КФМв·ЦОцЈәЈЁ1Ј©ёщҫЭЙъІъБчіМКҫТвНјЈ¬Ч°ЦГAКЗөзҪвіШЧ°ЦГЈ¬өзҪвұҘәНКіСОЛ®Ј¬ТтҙЛ»ҜС§·ҙУҰ·ҪіМКҪОӘЈә2NaClЈ«2H2O![]() 2NaOHЈ«H2ЎьЈ«Cl2ЎьЈ»ЈЁ2Ј©іэИҘФУЦКІ»ДЬТэИлРВөДФУЦКЈ¬јҙіэИҘMg2Ј«УГNaOHЈ¬іэИҘCa2Ј«УГNa2CO3Ј»ЈЁ3Ј©ўЩЧ°ЦГAУТ¶ЛІъЙъNaOHИЬТәЈ¬ЛөГчЧу¶Лөзј«КЗТхј«Ј¬·ўЙъ2H2OЈ«2eЈӯ=H2ЎьЈ«2OHЈӯЈ¬ТтҙЛYКЗЗвЖшЈ¬Ч°ЦГAөДЧу¶ЛКЗСфј«Ј¬·ўЙъ2ClЈӯЈӯ2eЈӯ=Cl2ЎьЈ¬XОӘCl2Ј¬әНNaOHИЬТәөД·ҙУҰКҪCl2Ј«2OHЈӯ=ClЈӯЈ«ClOЈӯЈ«H2OЈ»ўЪЧ°ЦГBЦРНЁСхЖшөДТ»ј«ОӘХэј«Ј¬»·ҫіКЗNaOHЈ¬ТтҙЛХэј«·ҙУҰКҪОӘO2Ј«2H2OЈ«4eЈӯ=4OHЈӯЈ¬ІъЙъNaOHЈ¬ТтҙЛb%>a%Ј»ўЫБҪХЯЧ°ЦГНЁ№эөДөзБҝПаөИЈ¬јҙЧӘТЖөДөзБҝКЗЈә11.2ЎБ4ЎБ6.02ЎБ1023ЎБ1.6ЎБ10Јӯ19/22.4C=1.93ЎБ105CЎЈ
2NaOHЈ«H2ЎьЈ«Cl2ЎьЈ»ЈЁ2Ј©іэИҘФУЦКІ»ДЬТэИлРВөДФУЦКЈ¬јҙіэИҘMg2Ј«УГNaOHЈ¬іэИҘCa2Ј«УГNa2CO3Ј»ЈЁ3Ј©ўЩЧ°ЦГAУТ¶ЛІъЙъNaOHИЬТәЈ¬ЛөГчЧу¶Лөзј«КЗТхј«Ј¬·ўЙъ2H2OЈ«2eЈӯ=H2ЎьЈ«2OHЈӯЈ¬ТтҙЛYКЗЗвЖшЈ¬Ч°ЦГAөДЧу¶ЛКЗСфј«Ј¬·ўЙъ2ClЈӯЈӯ2eЈӯ=Cl2ЎьЈ¬XОӘCl2Ј¬әНNaOHИЬТәөД·ҙУҰКҪCl2Ј«2OHЈӯ=ClЈӯЈ«ClOЈӯЈ«H2OЈ»ўЪЧ°ЦГBЦРНЁСхЖшөДТ»ј«ОӘХэј«Ј¬»·ҫіКЗNaOHЈ¬ТтҙЛХэј«·ҙУҰКҪОӘO2Ј«2H2OЈ«4eЈӯ=4OHЈӯЈ¬ІъЙъNaOHЈ¬ТтҙЛb%>a%Ј»ўЫБҪХЯЧ°ЦГНЁ№эөДөзБҝПаөИЈ¬јҙЧӘТЖөДөзБҝКЗЈә11.2ЎБ4ЎБ6.02ЎБ1023ЎБ1.6ЎБ10Јӯ19/22.4C=1.93ЎБ105CЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝФЪТ»ёцГЬұХИЭЖчЦРЈ¬·ўЙъПВБР·ҙУҰЈәCO2(g)Ј«C(s)![]() 2CO(g) ҰӨH>0Ј¬ҙпөҪЖҪәвәуЈ¬ёДұдПВБРМхјюЈ¬ФтЦё¶ЁОпЦКөДЕЁ¶Иј°ЖҪәвФхСщұд»ҜЈҝ
2CO(g) ҰӨH>0Ј¬ҙпөҪЖҪәвәуЈ¬ёДұдПВБРМхјюЈ¬ФтЦё¶ЁОпЦКөДЕЁ¶Иј°ЖҪәвФхСщұд»ҜЈҝ
ЈЁ1Ј©ФцјУCЈ¬ЖҪәв__________Ј¬c(CO)__________ЎЈ
ЈЁ2Ј©јхРЎГЬұХИЭЖчөДИЭ»эЈ¬ұЈіЦОВ¶ИІ»ұдЈ¬ФтЖҪәв__________Ј¬c(CO2)__________ЎЈ
ЈЁ3Ј©НЁИлN2Ј¬ұЈіЦГЬұХИЭЖчөДИЭ»эәНОВ¶ИІ»ұдЈ¬ФтЖҪәв__________Ј¬c(CO2)__________ЎЈ
ЈЁ4Ј©ұЈіЦГЬұХИЭЖчөДИЭ»эІ»ұдЈ¬ЙэёЯОВ¶ИЈ¬ФтЖҪәв__________Ј¬c(CO)__________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ШУЪНССхәЛЬХЛбөДПа№ШЛө·ЁХэИ·өДКЗЈЁ Ј©
A. »ҜС§ЧйіЙ°ьАЁБЧЛбЎўјо»щЎўНССхәЛМЗ
B. КЗТ»ЦЦЙъОпҙу·ЦЧУ
C. КЗЙъОпөДЦчТӘТЕҙ«ОпЦК
D. ГҝТ»ЦЦ¶јә¬УРЛДЦЦМШ¶ЁөДјо»щ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЙиОӘ°ў·ьјУөВВЮіЈКэөДЦөЎЈПВБРЛө·ЁХэИ·өДКЗ
AЈ®1Ј®6gУЙСхЖшәНіфСхЧйіЙөД»мәПОпЦРә¬УРСхФӯЧУөДКэДҝОӘ0.1![]()
BЈ®ұкЧјЧҙҝцПВЈ¬1LОмНйід·ЦИјЙХәуЙъіЙөДЖшМ¬ІъОпөД·ЦЧУКэОӘ5/22Ј®4![]()
CЈ®pH=13өДNaOHИЬТәЦРә¬УРөДOHЈӯОӘ0Ј®1mol
DЈ®ФЪ№эСх»ҜДЖУлЛ®өД·ҙУҰЦРЈ¬ГҝЙъіЙ0Ј®1molСхЖшЈ¬ЧӘТЖөзЧУөДКэДҝОӘ0.4![]()
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЧйіЙө°°ЧЦКөД°ұ»щЛбЦ®јдөДлДјьҪб№№КҪКЗЈЁ Ј©
A. NHЈӯCO B. ЈӯNHЈӯCOЈӯ C. ЈӯNH2ЈӯCOOHЈӯ D. NH2ЈӯCOOH
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘ4NH3+5O2ЈҪ4NO+6H2O Ј¬Иф·ҙУҰЛЩВК·ЦұрУГV(NH3)Ўў V(O2)ЎўV(NO)ЎўV(H2O)ұнКҫЈ¬ФтХэИ·өД№ШПөКЗ
A. ![]() V(NH3)=V(O2) B.
V(NH3)=V(O2) B. ![]() V(O2)=V(H2O)
V(O2)=V(H2O)
C. ![]() V(NH3)=V(H2O) D.
V(NH3)=V(H2O) D. ![]() V(O2)=V(NO)
V(O2)=V(NO)
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ СРҫҝМјј°Жд»ҜәПОпөДПа»ҘЧӘ»Ҝ¶ФДЬФҙөДід·ЦАыУГЎўөНМјҫӯјГУРЧЕЦШТӘөДЧчУГЎЈ
ўЕТСЦӘЈәўЩCH4(g)+H2O(g)![]() CO(g)+3H2(g) ЎчH1=+206.1kJЎӨmolЈӯ1
CO(g)+3H2(g) ЎчH1=+206.1kJЎӨmolЈӯ1
ўЪ2H2(g)+CO(g)![]() CH3OH(l) ЎчH2=Јӯ128.3kJЎӨmolЈӯ1
CH3OH(l) ЎчH2=Јӯ128.3kJЎӨmolЈӯ1
ўЫ2H2(g)+O2(g)![]() 2H2O(g) ЎчH3=Јӯ483.6kJЎӨmolЈӯ1
2H2O(g) ЎчH3=Јӯ483.6kJЎӨmolЈӯ1
25ЎжКұЈ¬ФЪәПККөДҙЯ»ҜјБЧчУГПВЈ¬ІЙУГјЧНйәНСхЖшТ»ІҪәПіЙТәМ¬јЧҙјөДИИ»ҜС§·ҪіМКҪОӘ ЎЈ
ўЖАыУГ·ҙУҰўЩАҙЦЖұёЗвЖшЈ¬ОӘБЛМҪҫҝОВ¶ИЎўС№Зҝ¶Ф·ҙУҰўЩЛЩВКЎўЧӘ»ҜВКөДУ°ПмЈ¬ДіН¬С§ЙијЖБЛТФПВИэЧй¶ФұИКөСй(ОВ¶ИОӘ400Ўж»т500ЎжЈ¬С№ЗҝОӘ101kPa»т404kPa)ЎЈ
КөСйРтәЕ | ОВ¶ИЎж | С№Зҝ/kPa | CH4іхКјЕЁ¶И/ molЎӨLЈӯ1 | H2OіхКјЕЁ¶И/ molЎӨLЈӯ1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
ўЩКөСй2әНКөСй3ПаұИЈ¬ЖдЖҪәвіЈКэ№ШПөКЗK2 K3(МоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°=Ўұ)ЎЈ
ўЪҪ«өИОпЦКөДБҝөДCH4әНЛ®ХфЖшідИл1LәгИЭГЬұХИЭЖчЦРЈ¬·ўЙъЙПКц·ҙУҰЈ¬ФЪ400ЎжПВҙпөҪЖҪәвЈ¬ЖҪәвіЈКэK=27Ј¬ҙЛКұИЭЖчЦРCOОпЦКөДБҝОӘ0.10molЈ¬ФтCH4өДЧӘ»ҜВКОӘ ЎЈ
ўЗ ҝЖС§јТМбіцУЙCO2ЦЖ ИЎ CөДМ«СфДЬ№ӨТХИзНј1ЛщКҫЎЈ
ўЩЎ°ЦШХыПөНі·ўЙъөД·ҙУҰЦРn(FeO):n(CO2)=6:1Ј¬ФтFe xOyөД»ҜС§КҪОӘ______________ЎЈ
ўЪЎ°ИИ·ЦҪвПөНіЎұЦРГҝ·ЦҪвl mol Fe xOyЈ¬ЧӘТЖөзЧУөДОпЦКөДБҝОӘ___________ЎЈ


Нј1 Нј2
ўИpCАаЛЖpHЈ¬КЗЦёј«ПЎИЬТәЦРөДИЬЦКЕЁ¶ИөДіЈУГёә¶ФКэЦөЎЈИфДіИЬТәЦРИЬЦКөДЕЁ¶ИОӘ1ЎБ10Јӯ3molЎӨLЈӯ1Ј¬ФтёГИЬТәЦРИЬЦКөДpCЈҪЈӯlg(1ЎБ10Јӯ3)ЈҪ3ЎЈИзНј2ОӘ25ЎжКұH2CO3ИЬТәөДpCЈӯpHНјЎЈЗл»ШҙрПВБРОКМв (ИфАлЧУЕЁ¶ИРЎУЪ10Јӯ5mol/LЈ¬ҝЙИПОӘёГАлЧУІ»ҙжФЪ)Јә
ўЩФЪН¬Т»ИЬТәЦРЈ¬H2CO3ЎўHCO3ЈӯЎўCO32Јӯ____________(МоЎ°ДЬЎұ»тЎ°І»ДЬЎұ)ҙуБҝ№ІҙжЎЈ
ўЪЗуH2CO3Т»ј¶өзАлЖҪәвіЈКэөДКэЦөKa1=________________ЎЈ
ўЫИЛМеСӘТәАпЦчТӘНЁ№эМјЛбЗвСО»әіеМеПө![]() ҝЙТФөЦПыЙЩБҝЛб»тјоЈ¬О¬іЦpH=7.4ЎЈөұ№эБҝөДЛбҪшИлСӘТәЦРКұЈ¬СӘТә»әіеМеПөЦРөД
ҝЙТФөЦПыЙЩБҝЛб»тјоЈ¬О¬іЦpH=7.4ЎЈөұ№эБҝөДЛбҪшИлСӘТәЦРКұЈ¬СӘТә»әіеМеПөЦРөД![]() ЧоЦХҪ«_________ЎЈ
ЧоЦХҪ«_________ЎЈ
AЈ®ұдҙу BЈ®ұдРЎ CЈ®»щұҫІ»ұд DЈ®ОЮ·ЁЕР¶П
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝҪ«Т»¶ЁЦКБҝөДГҫВБәПҪрН¶ИлөҪ200 mLТ»¶ЁОпЦКөДБҝЕЁ¶ИөДСОЛбЦР,әПҪрИ«ІҝИЬҪв,ПтЛщөГИЬТәЦРөОјУ 5 mol L-1өДNaOHИЬТәЦБ№эБҝ,ЙъіЙіБөнөДЦКБҝУлјУИлөДNaOHИЬТәөДМе»э№ШПөИзНјЛщКҫЎЈЗу:

ЈЁ1Ј©ФӯәПҪрЦРMgөДЦКБҝ gЈ»AlөДЦКБҝ g
ЈЁ2Ј©СОЛбөДОпЦКөДБҝЕЁ¶И mol/LЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝИзНјЛщКҫЈ¬Т»ГЬұХИЭЖчұ»ОЮДҰІБЎўҝЙ»¬¶ҜөДБҪёф°еaәНb·ЦіЙјЧЎўТТБҪКТЎЈұкЧјЧҙҝцПВЈ¬ФЪТТКТЦРідИл1.2molHClЈ¬јЧКТЦРідИлNH3ЎўH2өД»мәПЖшМеЈ¬ҫІЦ№Кұ»оИыО»ЦГИзПВНјЎЈТСЦӘјЧКТЦРЖшМеөДЦКБҝұИТТКТЦРЖшМеөДЦКБҝЙЩ33.8gЎЈ

Зл»ШҙрПВБРОКМвЈә
ЈЁ1Ј©јЧКТЦРЖшМеөДОпЦКөДБҝОӘ___________molЎЈ
ЈЁ2Ј©јЧКТЦРЖшМеөДЦКБҝОӘ__________gЎЈ
ЈЁ3Ј©јЧКТЦРNH3ЎўH2өДОпЦКөДБҝЦ®ұИОӘ_____________Ј¬ЦКБҝұИОӘ___________ЎЈ
ЈЁ4Ј©ҫӯ№эІйЧКБПЦӘөАHCl+NH3=NH4ClЈЁNH4ClіЈОВПВКЗ№ММеЈ¬јЩЙи№ММеөДМе»эҝЙәцВФЈ©Ј¬Из№ыҪ«°еaИҘөфЈ¬өұHClУлNH3НкИ«·ҙУҰә󣬻оИыbҪ«ҫІЦГУЪҝМ¶ИЎ°___________ЎұҙҰЈЁМоКэЧЦЈ©
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com