
【题目】向一定量的Fe、FeO和Fe2O3的混合物中加入60mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.09 molB.0.12 molC.0.16 molD.0.21 mol
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有_________个;
每个Na+离子周围与它最接近的、且距离相等的Na+共有__________个。而Na+离子数目与Cl-离子数目之比为______________。
在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。

试回答下列问题:
(2)NaCl晶体中离子键的键长为______________________。Na+离子半径与Cl-离子半径比r+/r- =____________。(已知 √2=1.414 , √3=1.732, √5=2.236)
(3)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25gNaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式为_______________________。
(4)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知![]() ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )

A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L1 NaHA溶液中:c(Na+)+c(A2)+c(H2A)+c(HA)=0.2 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要化工原料。结合以下路线回答下列问题。
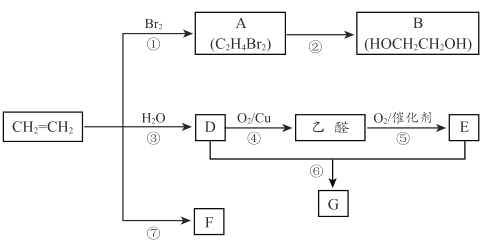
(1)反应①的化学方程式是 ____________________。
(2)B的官能团是_______________。
(3)反应④的化学方程式是_________________。
(4)F是一种高分子物质,可用于制作食品塑料袋等,F 的结构简式是__________。
(5)E的分子式是 C2H4O2能使紫色石蕊试液变红; G 是一种油状、有香味的物质,实验室用 D 和 E 通过反应⑥制取 G, 装置如图所示。
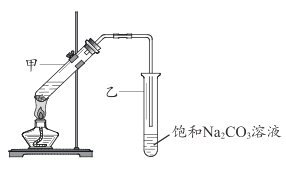
i.甲试管中反应的化学方程式是 __________;反应类型是_________。
ii.分离出试管乙中油状液体用到的主要仪器是___________________。
iii.如果将 4. 6g D 和 3g E 在催化剂条件下发生上述反应 ,充分反应后,如果实际产率为60%,实际得到G 的质量是__________ g。(已知:实际产率= 实际得到质量/理论计算质量)
(6)丙烯( CH3CH = CH2 ) 与乙烯互为同系物,在催化剂、加热条件下与O2 反应生成一种重要的化工原料丙烯酸( CH2= CHCOOH )。下列关于丙烯酸的说法正确的是 ________。
a.与乙酸互为同系物
b.能发生加成、酯化、氧化反应
c.能与 NaHCO3溶液反应生成 CO2
d.一定条件下能发生加聚反应,生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把河沙(主要成分是![]() )与镁粉按一定质量比(质量比略大于
)与镁粉按一定质量比(质量比略大于![]() )混合均匀,装入试管中加热大约
)混合均匀,装入试管中加热大约![]() 后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下发生反应的化学方程式:______。
(2)生成的混合物放入稀硫酸中,产生的气体是______(填分子式)。
(3)用化学方程式表示产生“爆炸声”的原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )

A.气态氢化物稳定性:R>Q
B.元素T的离子半径>元素R的离子半径
C.与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键
D.Q可形成多种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成药物诺氟沙星:
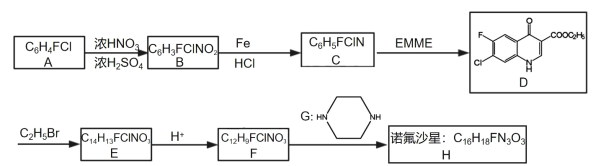
已知:
试剂EMME为C2H5OCH=C(COOC2H5)2,在适当条件下,可由C生成D。
②![]()
③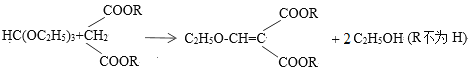
请回答:
(1)根据以上信息可知诺氟沙星的结构简式_____。
(2)下列说法不正确的是_____。
A.B到C的反应类型为取代反应
B.EMME可发生的反应有加成,氧化,取代,加聚
C.化合物E不具有碱性,但能在氢氧化钠溶液中发生水解
D.D中两个环上的9个C原子可能均在同一平面上
(3)已知:RCH2COOH![]() ,设计以化合物HC(OC2H5)3、C2H5OH合成EMME的合成路线(用流程图表示,无机试剂任选)_____。
,设计以化合物HC(OC2H5)3、C2H5OH合成EMME的合成路线(用流程图表示,无机试剂任选)_____。
(4)写出C→D的化学方程式______。
(5)写出化合物G的同系物M(C6H14N2)同时符合下列条件的同分异构体的结构简式:____
①1H-NMR谱表明分子中有4种氢原子,IR谱显示含有N-H键,不含N-N键;
②分子中含有六元环状结构,且成环原子中至少含有一个N原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com