
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和 0.5 mol·L-1硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填字母)。仪器C的名称是________,本实验所需玻璃仪器E规格和名称是___________________。

(2)下列操作中,容量瓶所不具备的功能有__________(填字母)。
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取220 mL体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度________(填“大于”“等于”或“小于”,下同)0.1 mol·L-1。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度______0.1 mol·L-1。
(4)根据计算得知:所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________ mL(计算结果保留一位小数)。如果实验室有10 mL、25 mL、50 mL量筒,应选用________ mL规格的量筒最好。
(5)如果定容时不小心超过刻度线,应如何操作:______________。
【答案】AC分液漏斗500ml容量瓶BCD小于大于13.625重配
【解析】
(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,用不到的仪器:平底烧瓶和分液漏斗;仪器C的名称为分液漏斗;需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL,实验室没有450mL容量瓶,所以应选择500mL容量瓶;(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,答案选BCD;(3)若定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏小;若NaOH溶液未冷却即转移至容量瓶定容,冷却后,溶液体积偏小,溶液浓度偏大;(4)质量分数为98%、密度为1.84g/cm3的浓硫酸物质的量浓度![]() =18.4mol/L。设0.5mol/L硫酸溶液500mL需要浓硫酸体积为V,则依据溶液稀释过程溶液所含溶质的物质的量保持不变得:V×18.4mol/L=0.5mol/L×500mL,解得V=13.6mL,用选择25mL量筒;(5)如果定容时不小心超过刻度线,实验失败,且不能补救,必须重新配制。
=18.4mol/L。设0.5mol/L硫酸溶液500mL需要浓硫酸体积为V,则依据溶液稀释过程溶液所含溶质的物质的量保持不变得:V×18.4mol/L=0.5mol/L×500mL,解得V=13.6mL,用选择25mL量筒;(5)如果定容时不小心超过刻度线,实验失败,且不能补救,必须重新配制。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
【实验Ⅰ】制备PCl3
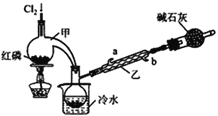
(1)实验室制备Cl2的原理是________________________。
(2)碱石灰的作用除了处理尾气外还有________________________。
(3)装置乙中冷凝水从_____(选填a或b)进入。
【实验Ⅱ】制备POCl3
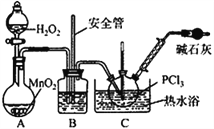
(4)实验室常用有微孔的试剂瓶保存H2O2,“微孔”与上述装置中的___________(仪器名称)目的是一致的。
(5)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+ 为指示剂,用0.2000mol/LKSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN )。
(6)POC13水解的化学反应方程式为________________________。
(7)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(8)反应中POC13的百分含量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,CO和CO2的混合气体共11.2L,质量为18 g
(1)求两种气体的物质的量之和是________。
(2)求混合气体的平均摩尔质量__________。
(3)求两种气体的体积分别是多少。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,则X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为________________________。
(2)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;Z分子的结构式________。
②A的化学式是________。
(3)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯:![]() ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用某种粗盐进行提纯实验,步骤见下图。请回答:
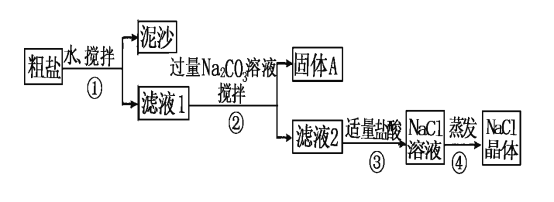
(1)步骤①和②的操作名称是________________。
(2)步骤②中判断加入碳酸钠是否过量的方法是_____________________
步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止__________________,当蒸发皿中有较多量固体出现时,应___________________________________。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ___________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,__________ | __________________ | 猜想Ⅲ成立 |
(4)写出“猜想Ⅲ”中对应的化学反应方程式:______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液可能含有AgNO3、NaCl、Na2CO3和Na2SO4中的一种。取少量该溶液于试管中,加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生。则该物质是( )
A.AgNO3B.NaClC.Na2SO4D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①R—NO2![]() R—NH2;
R—NH2;

③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯为原料制备某些化合物的转化关系图:
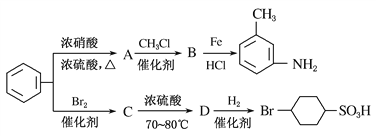
(1)A是一种密度比水________(填“小”或“大”)的无色液体;A转化为B的化学方程式是________________________。
(2)在“![]()
![]() ”的所有反应中属于取代反应的是________(填字母),属于加成反应的是________(填字母)。
”的所有反应中属于取代反应的是________(填字母),属于加成反应的是________(填字母)。
(3)B中苯环上的二氯代物有________种同分异构体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com