
【题目】已知:
①R—NO2![]() R—NH2;
R—NH2;

③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯为原料制备某些化合物的转化关系图:
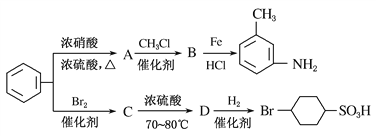
(1)A是一种密度比水________(填“小”或“大”)的无色液体;A转化为B的化学方程式是________________________。
(2)在“![]()
![]() ”的所有反应中属于取代反应的是________(填字母),属于加成反应的是________(填字母)。
”的所有反应中属于取代反应的是________(填字母),属于加成反应的是________(填字母)。
(3)B中苯环上的二氯代物有________种同分异构体。
【答案】 大 ![]()
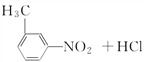 a、b c 6
a、b c 6
【解析】试题分析:本题以有机推断为载体,考查苯的性质,化学方程式的书写,有机反应类型的判断和同分异构体种类的确定。![]() 与浓硝酸、浓硫酸的混合酸共热发生硝化反应生成硝基苯,A为硝基苯,A的结构简式为
与浓硝酸、浓硫酸的混合酸共热发生硝化反应生成硝基苯,A为硝基苯,A的结构简式为![]() ;A+CH3Cl→B,B与Fe/HCl作用发生题给已知①的反应生成
;A+CH3Cl→B,B与Fe/HCl作用发生题给已知①的反应生成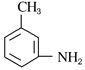 ,—CH3与—NH2处于间位,由此推出B为
,—CH3与—NH2处于间位,由此推出B为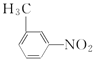 ,同时说明当苯环上有—NO2时新导入的取代基在—NO2的间位。
,同时说明当苯环上有—NO2时新导入的取代基在—NO2的间位。![]() 与Br2在催化剂存在时发生取代反应生成溴苯,C为溴苯,C的结构简式为
与Br2在催化剂存在时发生取代反应生成溴苯,C为溴苯,C的结构简式为![]() ,C与浓硫酸在70~80℃的条件下发生题给已知②的反应生成D,D与H2发生加成反应生成
,C与浓硫酸在70~80℃的条件下发生题给已知②的反应生成D,D与H2发生加成反应生成![]() ,—Br与—SO3H处于对位,推出D的结构简式为
,—Br与—SO3H处于对位,推出D的结构简式为![]() 。
。
(1)A是硝基苯,A是一种密度比水大的无色液体。A转化为B的化学方程式为: 。
。
(2)根据上面的分析,a为苯与Br2发生取代反应生成![]() ,b为
,b为![]() 与浓硫酸发生取代反应生成
与浓硫酸发生取代反应生成![]() ,c为
,c为![]() 与H2的加成反应,属于取代反应的是a、b;属于加成反应的是c。
与H2的加成反应,属于取代反应的是a、b;属于加成反应的是c。
(3)B的结构简式为 ,采用“定一移一”法确定二氯代物的种类,B的二氯代物有:
,采用“定一移一”法确定二氯代物的种类,B的二氯代物有: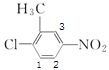 、
、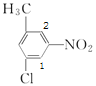 、
、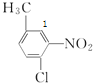 (数字代表第2个Cl的位置),共有3+2+1=6种。
(数字代表第2个Cl的位置),共有3+2+1=6种。


科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和 0.5 mol·L-1硫酸溶液450 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填字母)。仪器C的名称是________,本实验所需玻璃仪器E规格和名称是___________________。

(2)下列操作中,容量瓶所不具备的功能有__________(填字母)。
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取220 mL体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度________(填“大于”“等于”或“小于”,下同)0.1 mol·L-1。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度______0.1 mol·L-1。
(4)根据计算得知:所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________ mL(计算结果保留一位小数)。如果实验室有10 mL、25 mL、50 mL量筒,应选用________ mL规格的量筒最好。
(5)如果定容时不小心超过刻度线,应如何操作:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的说法正确的是( )
A.原子晶体中一定不含分子间作用力
B.离子晶体中一定只含离子键
C.分子晶体中一定含化学键
D.金属晶体的熔沸点一定高于分子晶体的熔沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径
元素 | N | S | O | Si |
原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是
A.1.10×10-10mB.1.20×10-10mC.0.80×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子可以在溶液中大量共存的是( )
A.K+、Mg2+、SO42﹣、OH﹣
B.Na+、H+、Cl﹣、HCO3﹣
C.K+、Ag+、NO3﹣、Cl﹣
D.K+、Cu2+、SO42﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,其气体密度是相同条件下H2的14倍,E是一种能使溴的四氯化碳溶液褪色的乙酸酯。A、B、C、D、E在一定条件下存在如下转化关系:
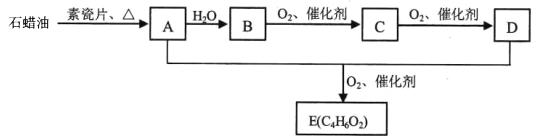
请回答:
(1)有机物C中含有的官能团名称是________ ;工业上,由石蜡油→ A的加工过程称为________。
(2)写 出 A+D+O2→ E的化学反应方程式________。
(3)下列说法不正确的是________。
A,75%(体积分数)的B溶液常用于医疗消毒
B.有机物E在 碱性条件下可发生皂化反应
C.有机物A能 与溴发生氧化反应使溴水褪色
D.用新制银氨溶液可鉴别有机物C、D、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中主族元素左上角与右下角元素性质相似,如Be和Al、B和Si、……,则下列说法错误的是
A.BeO是两性化合物B.Li2CO3和LiOH均易溶于水
C.1molBe与NaOH溶液反应可生成1molH2D.已知Si熔沸点高则B熔沸点也高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
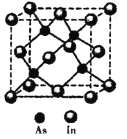
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元紧对应原子的M层电子排布式为________________。
(2)如下图2所示,每条折线表示周期表IVA-VIIA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是____________。
(3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为__________(填序号)。
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因__________。
(4)CO2在高温高压下所形成的晶体其晶胞如下图3所示。该晶体的熔点比SiO2晶体______(选填“高”或“低”),该晶体中碳原子轨道的杂化类型为____________。

(5)如图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;

则:C20分子共有____个正五边形,共有______条棱边。
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为______(填“有”或“无”)色离子,依据是___________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为p=5.71g/cm3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com