
【题目】已知下列元素的原子半径
元素 | N | S | O | Si |
原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是
A.1.10×10-10mB.1.20×10-10mC.0.80×10-10mD.0.70×10-10m
科目:高中化学 来源: 题型:
【题目】某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
【实验Ⅰ】试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是________。
(2)产生气泡的原因是____________________。
【实验Ⅱ】 试剂:未酸化的0.5 mol·L-1FeSO4溶液(pH = 3),5% H2O2溶液(pH = 5)
操作 | 现象 |
取2 mL5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊。测得反应后溶液pH=1.4 |
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加4mol·L-1盐酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有Fe2O3,经检验还含有SO42-。检验棕黄色沉淀中SO42-的方法是________。
(4)对于生成红褐色胶体的原因,提出两种假设:
i.H2O2溶液氧化Fe2+消耗H+
ii.Fe2+ 氧化的产物发生了水解
① 根据实验II记录否定假设i,理由是________。
② 实验验证假设ii:取Fe2(SO4)3溶液加热,溶液变为红褐色,pH下降,证明假设ii成立。
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是________。
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验II相同,除了产生与II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(6)产生刺激性气味气体的原因是________。
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与________(至少写两点)有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液可能含有AgNO3、NaCl、Na2CO3和Na2SO4中的一种。取少量该溶液于试管中,加入稀盐酸,无明显现象,再加入BaCl2溶液,有白色沉淀产生。则该物质是( )
A.AgNO3B.NaClC.Na2SO4D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
则4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3molL-1min-1,NO的转化率α1=_______。其他条件保持不变,若反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”、“<”或“=”)。
(3)汽车使用乙醇汽油可减少石油的消耗,并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 ,已知常温下NO2-的水解常数Kh=2×10-11 molL-1。 常温下某NaNO2和HNO2混合溶液的pH=5,则混合溶液中c(NO2-)和c(HNO2)的比值为_________。
(4)利用右图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为_______________。在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为___________________。
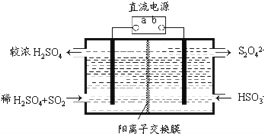
(5)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7,饱和亚硫酸中c(SO32-) =6.3×10-8 molL-1。将0.1 mol L-1的BaCl2溶液滴入饱和亚硫酸中,_____(填“能”、“不能”)生成BaSO3沉淀,原因是_______________________________(写出推断过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D;现将16 g A与70 g B混合,充分反应后,生成2 mol D和一定量的C,则D的摩尔质量为__________。
(2) 标准状况下,0.5molH2和 O2的混合气体所占的体积为________。
(3)8.5 g氢氧根离子含有的电子数目为________。
(4)14 g C2H4与C4H8的混合物所含质子的物质的量为________。
(5)将4gNaOH溶于__________g水中,可使溶液中H2O与Na+的物质的量之比等于20:1,若测得该溶液的密度为1.1g/cm3,则该溶液中c(Na+)为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学。请根据你所学过的化学知识,判断下列说法中错误的是
A. 医疗上常用体积分数为70%-75%的酒精作消毒剂
B. 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C. 海鲜、肉类等食品用福尔马林(甲醛溶液)浸泡防腐保鲜
D. 碘沾在手上立即用酒精洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①R—NO2![]() R—NH2;
R—NH2;

③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯为原料制备某些化合物的转化关系图:
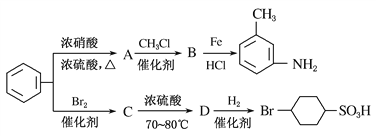
(1)A是一种密度比水________(填“小”或“大”)的无色液体;A转化为B的化学方程式是________________________。
(2)在“![]()
![]() ”的所有反应中属于取代反应的是________(填字母),属于加成反应的是________(填字母)。
”的所有反应中属于取代反应的是________(填字母),属于加成反应的是________(填字母)。
(3)B中苯环上的二氯代物有________种同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有以下物质:①石墨; ②氯化氢气体; ③酒精; ④铝; ⑤二氧化碳;
⑥碳酸氢钠固体;⑦氢氧化钡溶液; ⑧液态醋酸; ⑨氯化银固体; ⑩氨气。
(1)其中能导电的是:______________________________;
(2)属于非电解质的是:___________________________。
Ⅱ.氧化铜是一种黑色固体,可溶于稀硫酸,某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解,请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。

(3)通过实验Ⅰ可以证明_____________________________________________________.
(4)要证明另外两种粒子能否与氧化铜反应,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入_________,再加入___________。
(5)探究结果为_____________________________________________________________。
(6)反应的离子方程式为_____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com