
【题目】氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化。
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ)
2ClNO(g) K2 ΔH2<0 (Ⅱ)
则4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =________(用ΔH1、ΔH2表示);平衡常数K=______(用K1、K2表示)
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3molL-1min-1,NO的转化率α1=_______。其他条件保持不变,若反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2____α1(填“>”、“<”或“=”)。
(3)汽车使用乙醇汽油可减少石油的消耗,并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 ,已知常温下NO2-的水解常数Kh=2×10-11 molL-1。 常温下某NaNO2和HNO2混合溶液的pH=5,则混合溶液中c(NO2-)和c(HNO2)的比值为_________。
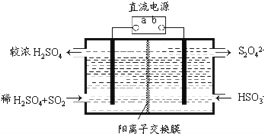
(4)利用右图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为_______________。在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为___________________。
(5)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的Ksp=5.48×10-7,饱和亚硫酸中c(SO32-) =6.3×10-8 molL-1。将0.1 mol L-1的BaCl2溶液滴入饱和亚硫酸中,_____(填“能”、“不能”)生成BaSO3沉淀,原因是_______________________________(写出推断过程)。
【答案】 2ΔH1-ΔH2 K12/K2 75% > 50 SO2+2H2O-2e-=SO42-+4H+ 4S2O42-+6NO2+8OH-=8SO42-+3N2↑+4H2O 不能 此时溶液中c(Ba2+)<0.1 mol· L-1 ,c(SO32-)<6.3×10-8mol· L-1,c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7
【解析】(1)反应:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)、2NO(g)+Cl2(g)
NaNO3(s)+ClNO(g) K1 ΔH1<0 (Ⅰ)、2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0 (Ⅱ),(Ⅰ)×2-(Ⅱ),则4NO2(g)+2NaCl(s)
2ClNO(g) K2 ΔH2<0 (Ⅱ),(Ⅰ)×2-(Ⅱ),则4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) ΔH =2ΔH1-ΔH2 (用ΔH1、ΔH2表示);平衡常数K= K12/K2 (用K1、K2表示)(2)测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则△n(ClNO)=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为0.15mol/0.2mol×100%=75%;正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1;(3)常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH-)=10-9mol·L-1,NO2-的水解常数K=c(HNO2)×c(OH-)/c(NO2-)=2×10-11mol·L-1,则混合溶液中c(NO2-)和c(HNO2)的比值为c(NO2-)/c(HNO2)=c(OH-)/2×10-11=50;(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为 4S2O42-+6NO2+8OH-=8SO42-+3N2↑+4H2O;(5)BaCl2溶液滴入饱和亚硫酸中,不能生成BaSO3沉淀,原因是此时溶液中c(Ba2+)<0.1 mol· L-1 ,c(SO32-)<6.3×10-8mol· L-1,浓度商Qc=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,所以不能产生沉淀。
2NaNO3(s)+2NO(g)+Cl2(g) ΔH =2ΔH1-ΔH2 (用ΔH1、ΔH2表示);平衡常数K= K12/K2 (用K1、K2表示)(2)测得10min内v(ClNO)=7.5×10-3mol·L-1·min-1,则△n(ClNO)=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol,由方程式可知参加反应NO物质的量为0.15mol,则NO的转化率为0.15mol/0.2mol×100%=75%;正反应为气体物质的量减小的反应,恒温恒容下条件下,到达平衡时压强比起始压强小,其他条件保持不变,反应(Ⅱ)在恒压条件下进行,等效为在恒温恒容下的平衡基础上增大压强,平衡正向移动,NO转化率增大,故转化率α2>α1;(3)常温下某NaNO2和 HNO2 混合溶液的PH为5,则溶液中c(OH-)=10-9mol·L-1,NO2-的水解常数K=c(HNO2)×c(OH-)/c(NO2-)=2×10-11mol·L-1,则混合溶液中c(NO2-)和c(HNO2)的比值为c(NO2-)/c(HNO2)=c(OH-)/2×10-11=50;(4)阳极发生氧化反应,阳极上是二氧化硫被氧化为硫酸根,阳极电极反应式为:SO2+2H2O-2e-=SO42-+4H+;在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体N2,同时有SO42-生成。该应的离子方程式为 4S2O42-+6NO2+8OH-=8SO42-+3N2↑+4H2O;(5)BaCl2溶液滴入饱和亚硫酸中,不能生成BaSO3沉淀,原因是此时溶液中c(Ba2+)<0.1 mol· L-1 ,c(SO32-)<6.3×10-8mol· L-1,浓度商Qc=c(Ba2+)×c(SO32-)<0.1×6.3×10-8=6.3×10-9<Ksp(BaSO3)=5.48×10-7,所以不能产生沉淀。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)E元素形成的氧化物对应的水化物的化学式为_______________________________。
(2)元素C、D、E形成的简单离子半径大小关系是____________(用离子符号表示)。
(3)用电子式表示化合物D2C的形成过程:_________________。C、D还可形成化合物D2C2,D2C2中含有的化学键类型是_______________________________________________。
(4)由A、B、C三种元素形成的离子化合物的化学式为__________________,它与强碱溶液共热,发生反应的离子方程式是______________________。
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为________________________(化学式用具体的元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
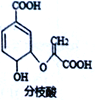
A. 分子中所有碳原子都在同一平面上
B. 可与乙醇、乙酸反应且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1的CH3COOH溶液所得滴定曲线如图。下列说法正确的是
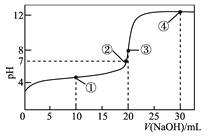
A. 点①所示溶液中:c(Na+)+c(H+)<CH3COOH)+c(OH-)
B. 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C. 点③所示溶液中:c(H+)= c(CH3COOH)+c(OH-)
D. 点④所示溶液中:2c(OH-)-2c(H+)= c(CH3COO-)+3c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的说法正确的是( )
A.原子晶体中一定不含分子间作用力
B.离子晶体中一定只含离子键
C.分子晶体中一定含化学键
D.金属晶体的熔沸点一定高于分子晶体的熔沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
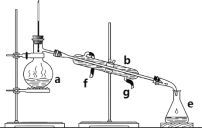
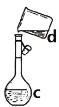
(1)写出下列仪器的名称:a.____________,b.___________,c.__________。
(2)仪器a~e中,使用前必须检查是否漏水的有___________。(填序号)
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在_______处。冷凝水由____口流出(填f或g)。
(4)现需配制0.1mol/LNaOH溶液450mL,装置是某同学转移溶液的示意图。
①图中的错误是_____________________________。
②根据计算得知,所需NaOH的质量为_______。
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)_____________。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
(5)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;容量瓶用蒸馏洗涤后残留有少量的水_____________;若定容时俯视刻度线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列元素的原子半径
元素 | N | S | O | Si |
原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是
A.1.10×10-10mB.1.20×10-10mC.0.80×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,其气体密度是相同条件下H2的14倍,E是一种能使溴的四氯化碳溶液褪色的乙酸酯。A、B、C、D、E在一定条件下存在如下转化关系:
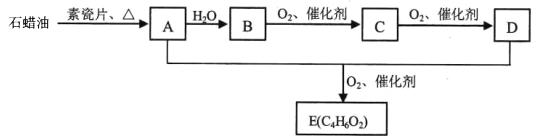
请回答:
(1)有机物C中含有的官能团名称是________ ;工业上,由石蜡油→ A的加工过程称为________。
(2)写 出 A+D+O2→ E的化学反应方程式________。
(3)下列说法不正确的是________。
A,75%(体积分数)的B溶液常用于医疗消毒
B.有机物E在 碱性条件下可发生皂化反应
C.有机物A能 与溴发生氧化反应使溴水褪色
D.用新制银氨溶液可鉴别有机物C、D、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚![]() ,同时利用此装置的电能在铁上镀铜,下列说法正确的是
,同时利用此装置的电能在铁上镀铜,下列说法正确的是
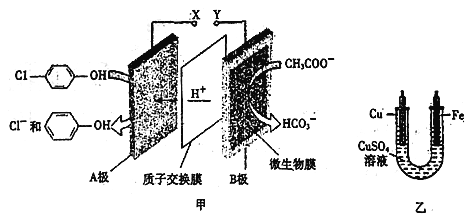
A. 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.2NA
B. A极的电极反应式为![]()
C. 铁电极应与Y相连接
D. 反应过程中甲中右边区域溶液pH逐渐升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com