
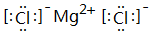 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.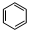 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$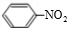 +H2O.
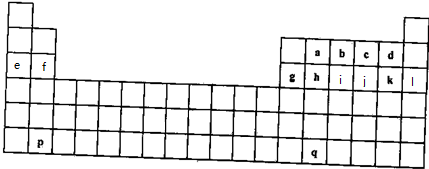
+H2O.分析 由元素在周期表中位置,可知a为C、b为N、c为O、d为F、e为Na、f为Mg、g为Al、h为Si、i为P、j为S、k为Cl、l为Ar.
(1)①碳元素形成有机物,形成化合物种类最多;
②最高价氧化物对应的水化物中酸性最强的是高氯酸;
③非金属性越强,阴离子的还原性越弱;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大;
(2)f与k形成化合物为MgCl2,由镁离子与氯离子构成;
(3)e最高价氧化物对应的水化物为NaOH,Al与氢氧化钠溶液反应生成Na[Al(OH)4]与氢气;实验室用二氧化锰与浓盐酸在加热条件下制备氯气;b最高价氧化物对应的水化物为硝酸,苯与浓硝酸、浓硫酸发生取代反应生成硝基苯;
(4)p、q之间有11列,其中第3列中含有15种元素,其余每一列含有1种元素,故二者原子序数形成26.
解答 解:由元素在周期表中位置,可知a为C、b为N、c为O、d为F、e为Na、f为Mg、g为Al、h为Si、i为P、j为S、k为Cl、l为Ar.
(1)①碳元素形成有机物,形成化合物种类最多,故答案为:碳;
②最高价氧化物对应的水化物中酸性最强的是HClO4,故答案为:HClO4;
③F元素非金属性最强,故阴离子的还原性最弱的为F-,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,简单阳离子半径最小的是Al3+,
故答案为:F-;Al3+;
(2)f与k形成化合物为MgCl2,由镁离子与氯离子构成,其电子式为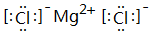 ,属于电解质,其溶于水所克服的微粒间作用力为离子键,
,属于电解质,其溶于水所克服的微粒间作用力为离子键,
故答案为: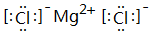 ;是;离子键;
;是;离子键;
(3)e最高价氧化物对应的水化物为NaOH,Al与氢氧化钠溶液反应生成Na[Al(OH)4]与氢气,化学反应离子方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,
实验室用二氧化锰与浓盐酸在加热条件下制备氯气,化学反应方程式为:MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
b最高价氧化物对应的水化物为硝酸,苯与浓硝酸、浓硫酸发生取代反应生成硝基苯,化学反应方程式为: +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$ +H2O,
+H2O,
故答案为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O; +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$ +H2O;
+H2O;
(4)p、q之间有11列,其中第3列中含有15种元素,其余每一列含有1种元素,故二者原子序数形成26,p的原子序数为x,则q的原子序数为x+26,
故答案为:x+26.
点评 本题考查元素周期表与元素周期律、常用化学用语等知识,注意理解同主族相邻元素以及同周期ⅡA族与ⅢA族原子序数关系.


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水污染的程度是由其溶氧量来测定 | |
| B. | 污染水的金属元素如汞、镉、铅等的含量极少时,不会对生物造成伤害 | |
| C. | 使用含磷洗衣粉会造成河水、湖水污染,使海藻疯狂生长,鱼类死亡 | |
| D. | 工业所排出的废水危害水生生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数是12 g碳中所含的碳原子数 | |
| B. | 24 g镁的原子最外层电子数为NA | |
| C. | 阿伏加德罗常数约是6.02×1023 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,与④的氢化物相比较,N的氢化物更稳定.
,与④的氢化物相比较,N的氢化物更稳定.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中和时所需NaOH的量 | B. | 电离的程度 | ||
| C. | H+的物质的量浓度 | D. | H+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N | O | F |
| P | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 | |
| C. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com