���о�NO
2��SO
2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1����֪��2SO
2��g��+O
2��g��?2SO
3��g����H=-Q
1kJ?mol
-12NO��g��+O
2��g��?2NO
2��g����H=-Q
2kJ?mol
-1��ӦNO
2��g��+SO
2��g��?SO
3��g��+NO��g�� �ġ�H=______kJ?mol
-1��
��2��һ�������£���NO
2��SO
2�������1��2�����ܱ������з���������Ӧ�������������Ӧƽ��ʱNO
2��NO�����Ϊ1��3����ƽ�ⳣ��K=______��
��3��CO�����ںϳɼ״�����Ӧ����ʽΪ��CO��g��+2H
2��g��?CH
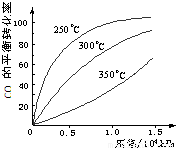
3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H______0���������������
����֪������һ�ֶ�Ԫ���ᣬ�������ƣ�NaHC
2O
4����Һ�����ԣ�
��1�������ӷ���ʽ����Na
2C
2O
4��Һ�Լ��Ե�ԭ��______��
��2�������£��Ƚ�0.1mol?L
-1NaHC
2O
4��Һ�и�������Ũ�ȵĴ�С��ϵ______��
��ij����С��Ϊ��̽����BaSO
4�ܽ�ȣ��ֱ�����BaSO
4���룺a.5ml ˮ��b.40ml 0.2mol?L
-1��Ba��OH��
2��Һ��c.20ml 0.5mol?L
-1��Na
2SO
4��Һ��d.40ml 0.1mol?L
-1��H
2SO
4��Һ�У��ܽ������ͣ�
��1�����ϸ���Һ�У���Ũ���ɴ�С��˳��Ϊ______��
A��b��a��c��d B��b��a��d��c C��a��d��c��b D��a��b��d��c
��2��ijͬѧȡͬ������Һb����Һdֱ�ӻ�ϣ�������Һ��pHֵΪ______��������Һ�����Ϊ���ǰ����Һ�����֮�ͣ���


 ���÷���ʽNO2��g��+SO2��g��?SO3��g��+NO��g�����ʱ������Ӧ�ĸı䣻
���÷���ʽNO2��g��+SO2��g��?SO3��g��+NO��g�����ʱ������Ӧ�ĸı䣻 ���÷���ʽNO2��g��+SO2��g��?SO3��g��+NO��g����H=
���÷���ʽNO2��g��+SO2��g��?SO3��g��+NO��g����H= ��
�� ��
�� x����ƽ��ʱ���������������=x-
x����ƽ��ʱ���������������=x- =
= x��������������=2x-
x��������������=2x- ��һ�����������=
��һ�����������= x��������������=
x��������������= x����ƽ�ⳣ��=
x����ƽ�ⳣ��= =1.8���ʴ�Ϊ��1.8��
=1.8���ʴ�Ϊ��1.8�� =0.1mol/L����C��H+��=10-13 mol/L������pH=13���ʴ�Ϊ��13��
=0.1mol/L����C��H+��=10-13 mol/L������pH=13���ʴ�Ϊ��13��

 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
 ��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮
��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮
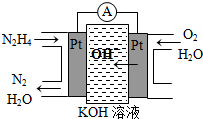 ���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش��������� ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮