
【题目】科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的唯一途径是实现燃料和燃烧产物之间的良性循环:
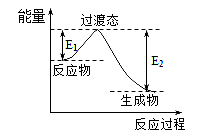
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2转化为甲醇蒸汽和水蒸气。下图是生成1molCH3OH时的能量变化示意图。
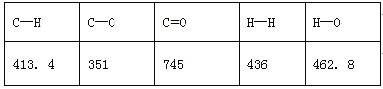
已知破坏1mol不同共价键的能量(kJ)分别是:
已知E1=8.2 kJ·mol-1,则E2=__________kJ·mol-1。
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
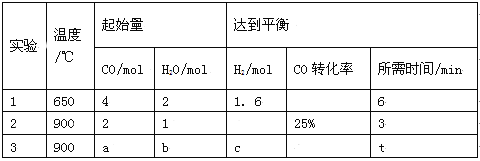
① 该反应的ΔH__________0(填“<” 或“>” )。
② 实验2条件下的平衡常数K= 。
③ 实验3中,若平衡时H2O的转化率为25%,则a/b=______。
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时V正 V逆(填“<” 或“>” 或“=”)。
(3)捕捉CO2可以利用Na2CO3溶液。先用Na2CO3溶液吸收CO2生成NaHCO3,然后使NaHCO3分解,Na2CO3可以进行循环使用。将100mL 0.1mol/LNa2CO3的溶液中通入112mL(已换算为标准状况)的CO2,溶液中没有晶体析出,则:
①反应后溶液中的各离子浓度由大到小的顺序是___________________________。
②反应后的溶液可以作“缓冲液”(当往溶液中加入一定量的酸和碱时,有阻碍溶液pH变化的作用),请解释其原理_____________________________________。
【答案】
(1)189.8
(2)① <;② 1/3 ③2:1; ④ ﹤
(3)① c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。② 反应后的溶液存在HCO3-![]() CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”。
CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”。
【解析】
试题分析:(1)已知CO2(g)+3H2(g)=H2O (g)+CH3OH(g)的△H=E1-E2=反应物的键能和-生成物的键能和=(745×2+436×3)-(462.8×2+413.4×3+351+462.8),则E2=189.8kJ·mol-1;
(2)①实验1中CO的转化率为![]() ×100%=40%,实验2中CO的转化率为25%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应;
×100%=40%,实验2中CO的转化率为25%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应;
②实验2条件下平衡常数,需要列式计算平衡浓度;
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.25mol/L 0.25mol/l 0.25mol/l 0.25mol/l
平衡浓度 0.25mol/L 0.75mol/L 0.25mol/l 0.25mol/l
K=![]() =
=![]() ;
;
③实验3在900℃条件下进行;
H2O(g)+CO(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
初始浓度 0.5bmol/L 0.5amol/L 0 0
转化浓度 0.25bmol/L 0.25bmol/l 0.25bmol/l 0.25bmol/l
平衡浓度 0.25bmol/L (0.5a-0.25b)mol/L 0.25bmol/l 0.25bmol/l
K=![]() =
=![]() ;解得a:b=2:1;
;解得a:b=2:1;
④ 实验4,若900℃时,在容器中加入CO、H2O、CO2、H2各1mol,则此时Qc=![]() =1>K,反应逆向进行,V正<V逆;
=1>K,反应逆向进行,V正<V逆;
(3)①反应后溶液中含有0.005molNa2CO3,0.01molNaHCO3,此时溶液显碱性,且CO32-的水解程度大于HCO3-,则溶液中的各离子浓度由大到小的顺序是 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
②反应后的溶液存在HCO3-![]() CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”。
CO32-+H+,加入少量的酸,平衡逆向移动,溶液pH变化不大;加入少量的碱平衡正向移动,溶液pH变化也不大,故该溶液可以作“缓冲液”。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,如图有机物分子中带“*”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的( )
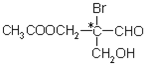
A. 与乙酸发生酯化反应
B. 与NaOH水溶液反应
C. 与银氨溶液作用只发生银镜反应
D. 催化剂作用下与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质架构和性质的重要工具。请参照元素①—⑦在周期表中的位置,回答下列问题:

(1)元素⑦在元素周期表的位置为____________。
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式 。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为 。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:
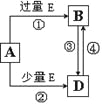
①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Ⅰ.按己知的原子结构规律,82号元素X应是第_________周期_________族元素,它的最高正价氧化物的化学式为_________。
Ⅱ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解。用序号填空:
(1)未破坏化学键的是_____________。
(2)仅离子键被破坏的是_____________。
(3)仅共价键被破坏的是_____________。
Ⅲ.有下列各组物质:①石墨和足球烯C60;②126C和136C;③CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3;④漂白粉和漂白液主要成分;⑤正丁烷和异庚烷;⑥乙烯和聚乙烯;⑦![]() 和
和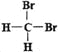 ;⑧丙烷和环丙烷。用序号填空:
;⑧丙烷和环丙烷。用序号填空:
(1)__________组两者互为同位素。(2)__________组两者互为同素异形体。
(3)__________组两者属于同系物。(4)__________组两者互为同分异构体。
(5)__________组两者是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:SiO2+C+N2![]() Si3N4+CO。该反应变化过程中的能量变化如图所示。回答以下问题。
Si3N4+CO。该反应变化过程中的能量变化如图所示。回答以下问题。

(1)上述反应中的还原剂是__________,其还原产物是________。
(2)该反应________(填“吸热”或“放热”),反应热ΔH________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
(2)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
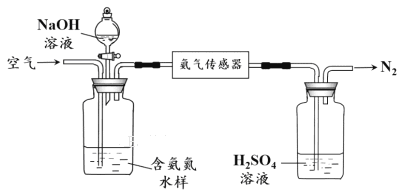
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol ,则水样中氨氮(以氨气计)含量为 mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
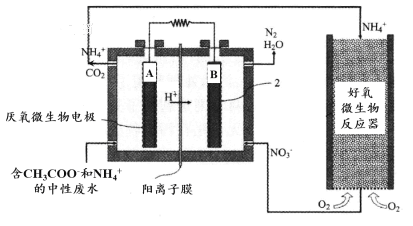
① 已知A、B两极生成CO2和N2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D原子序数之和是C的原子序数的1.5倍。
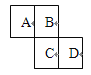
(1)写出A、B、C、D的元素符号:A 、B 、
C 、D 。
(2)A、B、C、D的气态氢化物最不稳定的是(写化学式) 。
(3)A、D两元素的气态氢化物相互反应的化学方程式为 ,现象为 ,产物为 化合物(填“离子”或“共价”)。该化合物中存在的化学键有 (填“离子键”或“共价键”)。
(4)写出下列电子式:
D的气态氢化物 ,A单质 。B的气态氢化物的形成过程用电子式表示: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
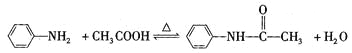
【题目】乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂和防腐剂、乙酰苯胺的制备原理为
实验参数
名称 | 相对分 | 性状 | 密度(g/mL) | 沸点( | 溶解性 | |
苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
实验装置如图所示(部分仪器及夹持装置已略去)。
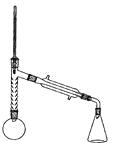
注:①刺型分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。②苯胺易被氧化。
实验步骤:
步骤1:在100mL圆底烧瓶中加入无水苯胺9.3mL、冰醋酸18.4mL、锌粉0.1g和少量沸石,安装好仪器后,对圆底烧瓶均匀加热,使反应液在微沸状态下回流,调节加热温度,使温度计温度控制在105![]() 左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
左右;反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步骤2:在搅拌下,趁热将蒸馏烧瓶中的液体以细流状倒入盛有冰水的100mL烧杯中,快速搅拌,乙酰苯胺结晶析出,烧杯内试剂冷却至室温后,进行抽滤、洗涤、干燥,可得到乙酰苯胺粗品。
步骤3:将乙酰苯胺粗品进行重结晶,待结晶完全后抽滤,尽量压甘干滤饼。将产品置于干净的表面皿中晾干,称重,计算产率、
请回答下列问题:
(1)实验中加入锌粉的目的是_____________________。
(2)从化学平衡的角度分析,控制温度计的温度在105![]() 左右的原因是______________。
左右的原因是______________。
(3)通过_____________可判断反应基本完成、
(4)步骤1加热可用_____________(填“水浴”或“油浴”)。
(5)洗涤乙酰苯胺粗品最合适的方法是__________________(填字母)。
A.用少量冷水洗
B.用少量热水洗
C.先用冷水洗,再用热水洗
D.用酒精洗
(6)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,______________,再将滤液冷却结晶。
(7)该实验最终得到产品9.1g,则乙酰苯胺的产率是____________(小数点后保留两位数字。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫-氨热化学循环制氢示意图如下:
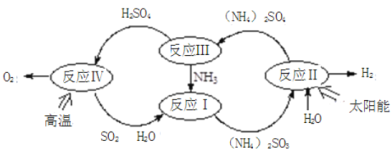
(1)反应Ⅱ是将太阳能转化为电能,再转化为化学能,电解池阳极的电极反应式 _______________;
(2)反应Ⅲ中控制反应条件很重要,不同条件下硫酸铵分解产物不同。连接装置A-B-C,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A 至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、B之间的导气管内有少量白色固体。经检验,该白色固体和装置B内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
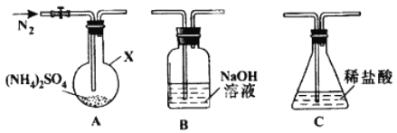
(NH4)2 SO4在400℃分解的化学方程式是:________________________________________;
(3)反应Ⅳ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O (l) △H=+462kJ/mol
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177kJ/mol
ii.SO3(g)分解。
iii.H2O(l)=H2O(g) △H=+44kJ/mol
①L(L1、L2),X可分别代表压强或温度。下图表示 L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
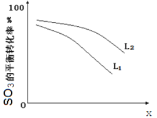
i.X代表的物理量是:________________,
ii.判断L1、L2的大小关系,并简述理由:________________________________________;
②反SO3分解的热化学方程式为:__________________________________________________;
(4)恒温密闭容器中,控制不同温度进行SO3分解实验。SO3起始浓度均为 cmol·L-1,测定SO3的转化率,结果如图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。
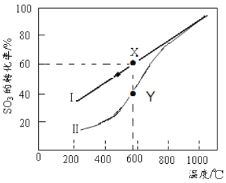
①图中点X点平衡常数:K=_____ ;
②Y点对应温度下的反应速率:v(正)______v(逆)(选填:>,<,=);随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com