
【题目】光导纤维的应用使人们可以在家中坐享“互联网+”带来的变革与实惠,下列物质中可以用来生产光导纤维的是( )
A.硫
B.二氧化硅
C.铁
D.氧化铝
科目:高中化学 来源: 题型:
【题目】为证明铜丝与稀硝酸反应生成的确实是NO,某同学设计了一套装置(如图1所示),有关该实验叙述不正确的是

A. 为保证实验效果,反应开始前,稀硝酸可加到与两侧胶塞相平的位置。
B. 利用该装置可控制反应随时停止或继续反应
C. 生成的气体可利用图2装置来收集
D. 长玻璃管的作用可防止稀硝酸溢出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极. 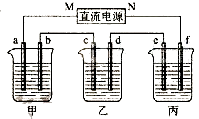
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为极;
②电极b上发生的电极反应为;
③列式计算电极b上生成的气体在标准状况下的体积:
④电极c的质量变化是g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液;
乙溶液;
丙溶液;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应:CO(g)+2H2(g)![]() CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CH3OH) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(1)下图中表示CH3OH的浓度变化的曲线是_________(填字母)。

(2)用H2表示从0~2s内该反应的平均速率v(H2) =__________。随着反应的进行,该反应的速率在逐渐减慢的原因是 _____________。
(3)能说明该反应已达到平衡状态的是________。
a.容器内CO与CH3OH的浓度相等 b.v逆(CO) = v正(H2)
c.容器内气体的密度保持不变 d.容器内气体的压强不变
(4)该反应是一个放热反应,说明该反应中破坏1mol CO和2mol H2的化学键吸收的能量_________形成1mol CH3OH释放的能量(填“﹤”、“=”或“﹥”)。
(5)已知在400 ℃时,反应CO(g)+2H2(g)![]() CH3OH(g) 生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q =_________kJ。
CH3OH(g) 生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q =_________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
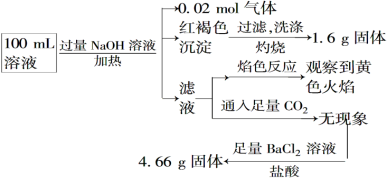
下列说法正确的是
A.原溶液中c(Fe3+)=0.2 mol·L-1
B.要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+
C.SO42-、NH4+、Na+一定存在,CO32-,Al3+一定不存在
D.溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年我国科研人员研制出一种室温“可呼吸”NaCO2电池。放电时该电池“吸入”CO2 , 充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是:( )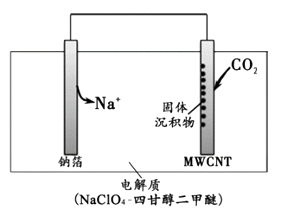
A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入”CO2时的正极反应:4Na+ + 3CO2 + 4e-= 2Na2CO3 + C
D.标准状况下,每“呼出”22.4LCO2 , 转移电子数为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
(1)过程I,发生反应的离子方程式是。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下: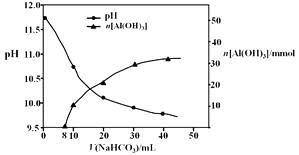
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是。
② 过程II生成Al(OH)3的离子方程式是。
(3)过程III,电解Na2CO3溶液的装置如下图所示。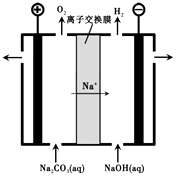
①阴极的电极反应式是。
②简述阳极液生成的原理:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X为
A. Cl2 B. Cl2O C. Cl2O3 D. ClO2
【答案】D
【解析】试题分析:根据转移电子数守恒得,1molNaI中的碘元素由-1价生成单质碘,化合价升高转移1mol电子,故NaClO3中的氯元素化合价降低转移1mol电子,故X气体中氯元素的价态为+4价,答案选D.
考点:氧化还原反应
【题型】单选题
【结束】
25
【题目】把4.48LCO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com