
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
(1)过程I,发生反应的离子方程式是。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下: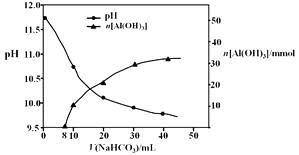
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是。
② 过程II生成Al(OH)3的离子方程式是。
(3)过程III,电解Na2CO3溶液的装置如下图所示。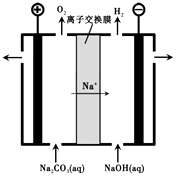
①阴极的电极反应式是。
②简述阳极液生成的原理:。
【答案】
(1)Al2O3+2OH-=2AlO2-+H2O
(2)OH-+HCO3-=CO32-+H2O,HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
(3)2H2O+2e-=2OH-+H2↑,2H2O-4e-=O2↑+4H+,溶液中c(H+)增大,发生反应:CO32-+H+=HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液
【解析】解:(1)过程I,铝土矿中氧化铝与碱反应生成偏铝酸钠根离子和水,反应的离子方程式为Al2O3 + 2OH-= 2AlO2-+ H2O,
故答案为:Al2O3 + 2OH-= 2AlO2-+ H2O;
(2)① 加入NaHCO3溶液体积小于8 mL时,没有氢氧化铝沉淀生成,主要反应的离子方程式为OH- + HCO3-= CO32-+ H2O,
故答案为:OH- + HCO3-= CO32-+ H2O;
② 过程II中碳酸氢根离子与偏铝酸钠根离子发生复分解反应,生成氢氧化铝沉淀和碳酸根,生成Al(OH)3的离子方程式为HCO3-+ AlO2-+ H2O = Al(OH)3↓+ CO32-,
故答案为:HCO3-+ AlO2-+ H2O = Al(OH)3↓+ CO32-;
(3)①根据图像,阴极放出氢气,溶液中的水放电,电极反应式为2H2O + 2e-= 2OH-+ H2↑,
故答案为:2H2O + 2e-= 2OH-+ H2↑;
②2H2O - 4e-= O2↑+ 4H+,溶液中c(H+)增大,发生反应:CO32-+ H+ = HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液,
故答案为:2H2O - 4e-= O2↑+ 4H+,溶液中c(H+)增大,发生反应:CO32-+ H+ = HCO3-,部分Na+透过离子交换膜向阴极移动,最终获得含NaHCO3的阳极液。
(1)氧化铝属于两性氧化物,与强碱反应生成偏铝酸盐和水;
(2)根据氢氧化铝的溶解平衡和碳酸氢根离子与氢离子的反应进行分析即可;
(3)根据电解原理分析电极反应即可.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为 ![]() Fe2O3(s)+CO(g)=
Fe2O3(s)+CO(g)= ![]() Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=、CO的平衡转化率=:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量
B.增加Fe203的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P可用作光电材料,其合成路线如下:
已知: ![]() (R、R’表示氢或烃基)
(R、R’表示氢或烃基)

(1)烃A的相对分子质量是26,其结构简式是。
(2)反应①的反应类型是。
(3)C中含有的官能团是。
(4)D为苯的同系物,反应③的化学方程式是。
(5)G的结构简式是。
(6)反应⑨的化学方程式是。
(7)反应⑤和⑦的目的是。
(8)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L1。
①用化学用语解释FeCl3溶液呈酸性的原因:。
②下列实验方案中,能使FeCl3溶液pH升高的是(填字母序号)。
a.加水稀释 b. 加入FeCl3固体
c.滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:。
② 用离子方程式解释反应后溶液为浅绿色的原因:。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4 , 理由是。
(3)为进一步探究上述1.0 mol·L1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作 | 现象 |
将5 mL 1.0 mol·L1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L1 FeCl3溶液中,Fe3+的氧化性比H+更强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( ) 
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应 ![]() H2(g)+
H2(g)+ ![]() X2(g)HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
X2(g)HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5%
B.17%
C.25%
D.33%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com