
【题目】高炉炼铁过程中发生的主要反应为 ![]() Fe2O3(s)+CO(g)=
Fe2O3(s)+CO(g)= ![]() Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=、CO的平衡转化率=:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量
B.增加Fe203的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
【答案】
(1)![]() ;<
;<
(2)0.006mol/(L?min);60%
(3)C
【解析】解:(1)由平衡常数是指在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值,但需要注意但是固体和纯液体的浓度视为常数,不能出现在表达式中,则K= ![]() ,又从表中数据可知随着温度的升高平衡常数逐渐减小,则说明温度升高平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,所以答案是:
,又从表中数据可知随着温度的升高平衡常数逐渐减小,则说明温度升高平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,所以答案是: ![]() ;<;(2)设CO转化的物质的量为x,则
;<;(2)设CO转化的物质的量为x,则
| CO(g) | ═ |
| CO2(g) | |
起始量(mol) | 1.0 | 1.0 | |||
转化的量(mol) | x | x | |||
平衡时的量(mol) | 1.0﹣x | 1.0+x |
又在1000℃时K=4.0,则有 ![]() =4.0,解得x=0.6, CO2的浓度变化量为:c(CO2)=
=4.0,解得x=0.6, CO2的浓度变化量为:c(CO2)= ![]() =0.06mol/L,则用二氧化碳表示的反应速率为
=0.06mol/L,则用二氧化碳表示的反应速率为 ![]() =0.006mol/(L.min),CO的转化率为
=0.006mol/(L.min),CO的转化率为 ![]() ×100%=60%,所以答案是:0.006mol/(L.min);60%;(3)若提高CO的平衡转化率,则化学平衡向正反应方向移动,因Fe、Fe2O3都是固体,改变质量平衡不移动,故AB不选;移出二氧化碳气体,减小生成物中气体的浓度,则平衡正向移动,故C选;因反应为放热反应,则升高温度,平衡向逆反应方向移动,故D不选;因该反应前后气体的体积不变,则减小容器的容积,平衡不移动,故E不选;因催化剂对平衡移动无影响,则加入合适的催化剂不能使平衡移动,故F不选;所以答案是:C.
×100%=60%,所以答案是:0.006mol/(L.min);60%;(3)若提高CO的平衡转化率,则化学平衡向正反应方向移动,因Fe、Fe2O3都是固体,改变质量平衡不移动,故AB不选;移出二氧化碳气体,减小生成物中气体的浓度,则平衡正向移动,故C选;因反应为放热反应,则升高温度,平衡向逆反应方向移动,故D不选;因该反应前后气体的体积不变,则减小容器的容积,平衡不移动,故E不选;因催化剂对平衡移动无影响,则加入合适的催化剂不能使平衡移动,故F不选;所以答案是:C.
【考点精析】掌握反应速率的定量表示方法和化学平衡状态本质及特征是解答本题的根本,需要知道反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a KJ·mol-1 (a>0)
②2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b KJ·mol-1 (b>0)
若用标准状况下3.36LNO2氧化CO至CO2(NO2完全反应)的整个过程中转移电子的物质的量为_____mol,放出的热量为_________ kJ(用含有a和b的代数式表示)。
(2)己知下列反应的反应热:
①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H=-870.3kJ/mo1
②C(s)+O2(g) =CO2(g) ΔH=-393.5kJ/mo1
③2C(s)+2H2(g)+O2(g) =CH3COOH(1) ΔH=-488.3kJ/mo1
请写出H2燃烧热的热化学方程式______________________________________。
(3)在101kPa下,CH4(g)、H2(g)、C(s) 的燃烧热分别为890.3kJ/mol、285.8kJ/mol 和393.5kJ/mol,则CH4(g)分解为H2(g)、C(s)的热化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明铜丝与稀硝酸反应生成的确实是NO,某同学设计了一套装置(如图1所示),有关该实验叙述不正确的是

A. 为保证实验效果,反应开始前,稀硝酸可加到与两侧胶塞相平的位置。
B. 利用该装置可控制反应随时停止或继续反应
C. 生成的气体可利用图2装置来收集
D. 长玻璃管的作用可防止稀硝酸溢出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行SO2的性质实验。在点滴板a、b、c处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如下表所示。( )
序号 | 试剂 | 实验现象 |
|
a | 品红溶液 | 红色褪去 | |
b | 酸性KMnO4溶液 | 紫色褪去 | |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
下列说法正确的是
A.浓硫酸与Na2SO3固体发生了氧化还原反应
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+ 2OH—= SO32-+ H2O
D.c中所得溶液的离子浓度一定存在关系:c(Na+)+c(H+) = 2c(SO32-) +c(HSO3) + c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用右图所示装置制备乙酸乙酯。实验如下:( )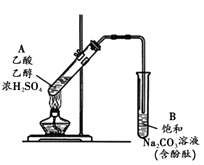
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A.①中加热利于加快酯化反应速率,故温度越高越好
B.③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C.③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D.取②中上层油状液体测其,共有3组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极. 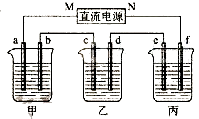
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为极;
②电极b上发生的电极反应为;
③列式计算电极b上生成的气体在标准状况下的体积:
④电极c的质量变化是g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液;
乙溶液;
丙溶液;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应:CO(g)+2H2(g)![]() CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CH3OH) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(1)下图中表示CH3OH的浓度变化的曲线是_________(填字母)。

(2)用H2表示从0~2s内该反应的平均速率v(H2) =__________。随着反应的进行,该反应的速率在逐渐减慢的原因是 _____________。
(3)能说明该反应已达到平衡状态的是________。
a.容器内CO与CH3OH的浓度相等 b.v逆(CO) = v正(H2)
c.容器内气体的密度保持不变 d.容器内气体的压强不变
(4)该反应是一个放热反应,说明该反应中破坏1mol CO和2mol H2的化学键吸收的能量_________形成1mol CH3OH释放的能量(填“﹤”、“=”或“﹥”)。
(5)已知在400 ℃时,反应CO(g)+2H2(g)![]() CH3OH(g) 生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q =_________kJ。
CH3OH(g) 生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q =_________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
(1)过程I,发生反应的离子方程式是。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下: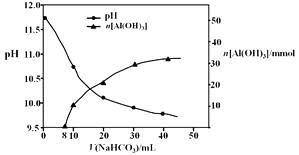
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是。
② 过程II生成Al(OH)3的离子方程式是。
(3)过程III,电解Na2CO3溶液的装置如下图所示。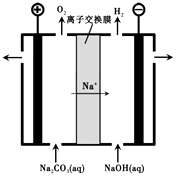
①阴极的电极反应式是。
②简述阳极液生成的原理:。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com