
����Ŀ�����ܸ߷���P�����������ϣ���ϳ�·�����£�
��֪�� ![]() ��R��R����ʾ���������
��R��R����ʾ���������

��1����A����Է���������26����ṹ��ʽ����
��2����Ӧ�ٵķ�Ӧ��������
��3��C�к��еĹ���������
��4��DΪ����ͬϵ���Ӧ�۵Ļ�ѧ����ʽ����
��5��G�Ľṹ��ʽ����
��6����Ӧ��Ļ�ѧ����ʽ����
��7����Ӧ�ݺ͢ߵ�Ŀ������
��8������Ȳ�ͼ�ȩΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�1,3-����ϩ��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
���𰸡�
��1��![]()
��2���ӳɷ�Ӧ
��3��̼̼��������ԭ��
��4��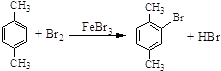
��5��
��6��
��7�����������ϵģ��ӣ��ǻ�
��8��![]()
![]()
![]()
![]()
![]()
![]()
![]()
���������⣺���ݹ��ܸ߷���P 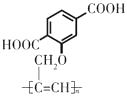 ����֪HΪ
����֪HΪ 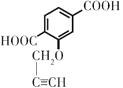 ����A����Է���������26��AΪ��Ȳ��
����A����Է���������26��AΪ��Ȳ�� ![]() ����������Ϣi����Ȳ���ȩ��Ӧ����B��BΪ
����������Ϣi����Ȳ���ȩ��Ӧ����B��BΪ ![]() ��B��HBr����ȡ����Ӧ����C��CΪ
��B��HBr����ȡ����Ӧ����C��CΪ ![]() ����������ͼ��DΪ�Զ��ױ�
����������ͼ��DΪ�Զ��ױ� ![]() ��EΪ
��EΪ 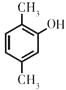 ��FΪ
��FΪ 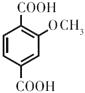 ��GΪ
��GΪ 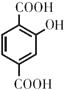 ����1����A����Է���������26������Ȳ���ʴ�Ϊ��
����1����A����Է���������26������Ȳ���ʴ�Ϊ�� ![]() ����2�����ݷ�Ӧԭ������Ӧ�����ڼӳɷ�Ӧ���ʴ�Ϊ���ӳɷ�Ӧ����3��CΪ
����2�����ݷ�Ӧԭ������Ӧ�����ڼӳɷ�Ӧ���ʴ�Ϊ���ӳɷ�Ӧ����3��CΪ ![]() �����к��еĹ�������̼̼��������ԭ�ӣ��ʴ�Ϊ��̼̼��������ԭ�ӣ���4��DΪ�Զ��ױ�
�����к��еĹ�������̼̼��������ԭ�ӣ��ʴ�Ϊ��̼̼��������ԭ�ӣ���4��DΪ�Զ��ױ� ![]() ����Ӧ�۵Ļ�ѧ����ʽΪ
����Ӧ�۵Ļ�ѧ����ʽΪ 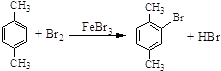 ���ʴ�Ϊ��
���ʴ�Ϊ�� 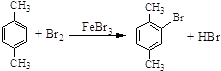 ����5��GΪ
����5��GΪ  ���ʴ�Ϊ��
���ʴ�Ϊ�� 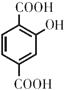 ����6����Ӧ��Ļ�ѧ����ʽΪ
����6����Ӧ��Ļ�ѧ����ʽΪ  ���ʴ�Ϊ��
���ʴ�Ϊ��  ����7����Ʒ�Ӧ�ݺ͢ߵ�Ŀ���DZ��������ϵģ��ӣ��ǻ������������ʴ�Ϊ�����������ϵģ��ӣ��ǻ�����8�������������ͼ����Ϣ������Ȳ�ͼ�ȩΪԭ�Ϻϳ�1,3-����ϩ������������Ȳ���ȩ�ӳ�����
����7����Ʒ�Ӧ�ݺ͢ߵ�Ŀ���DZ��������ϵģ��ӣ��ǻ������������ʴ�Ϊ�����������ϵģ��ӣ��ǻ�����8�������������ͼ����Ϣ������Ȳ�ͼ�ȩΪԭ�Ϻϳ�1,3-����ϩ������������Ȳ���ȩ�ӳ����� ![]() �����������ӳ�����
�����������ӳ����� ![]() �������Ũ�������ʱ�����ǻ�����ȥ��Ӧ���ɣ�����ͼΪ��
�������Ũ�������ʱ�����ǻ�����ȥ��Ӧ���ɣ�����ͼΪ�� ![]()
![]()
![]()
![]()
![]()
![]()
![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]()
![]()
![]()
![]()
![]()
![]()
![]() ��
��
������A����Է���������26�ж�AΪ��Ȳ(![]() )�� ����л��������ת����ϵ������Ϣ�����ý����л���������жϣ�Ȼ����������н��.
)�� ����л��������ת����ϵ������Ϣ�����ý����л���������жϣ�Ȼ����������н��.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����SO2������ʵ�顣�ڵ�ΰ�a��b��c���ֱ���в�ͬ���Լ�������Na2SO3�����ϵμ�����ŨH2SO4����������ΰ��ϸ���������һ��ʱ���۲쵽��ʵ���������±���ʾ��( )
��� | �Լ� | ʵ������ |
|
a | Ʒ����Һ | ��ɫ��ȥ | |
b | ����KMnO4��Һ | ��ɫ��ȥ | |
c | NaOH��Һ����2�η�̪�� | ��ɫ��ȥ |
����˵����ȷ����
A.Ũ������Na2SO3���巢����������ԭ��Ӧ
B.a��b������SO2����Ư����
C.c��ֻ���ܷ�����Ӧ��SO2+ 2OH��= SO32-+ H2O
D.c��������Һ������Ũ��һ�����ڹ�ϵ��c(Na+)+c(H+) = 2c(SO32-) +c(HSO3) + c(OH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������״���;����㷺��Խ��Խ�����̼ҵĹ�ע����ҵ�ϼ״��ĺϳ�;�����ֶ���������ʵ������ģ��״��ϳɷ�Ӧ����2 L�ܱ������ڣ�400 ��ʱ������Ӧ��CO(g)+2H2(g)![]() CH3OH(g)����ϵ�м״������ʵ���n(CH3OH)��ʱ��ı仯�����
CH3OH(g)����ϵ�м״������ʵ���n(CH3OH)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 5 |
n(CH3OH) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
��1����ͼ�б�ʾCH3OH��Ũ�ȱ仯��������_________������ĸ����

��2����H2��ʾ��0~2s�ڸ÷�Ӧ��ƽ������v(H2) ��__________�����ŷ�Ӧ�Ľ��У��÷�Ӧ��������������ԭ���� _____________��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��������CO��CH3OH��Ũ����� b��v��(CO) �� v��(H2)
c��������������ܶȱ��ֲ��� d�������������ѹǿ����
��4���÷�Ӧ��һ�����ȷ�Ӧ��˵���÷�Ӧ���ƻ�1mol CO��2mol H2�Ļ�ѧ�����յ�����_________�γ�1mol CH3OH�ͷŵ����������������=����������
��5����֪��400 ��ʱ����ӦCO(g)+2H2(g)![]() CH3OH(g) ����1 mol CH3OH(g)���ų�������Ϊ116 kJ������������Ӧ�ﵽƽ��ʱ�ų�������Q ��_________kJ��
CH3OH(g) ����1 mol CH3OH(g)���ų�������Ϊ116 kJ������������Ӧ�ﵽƽ��ʱ�ų�������Q ��_________kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016���ҹ�������Ա���Ƴ�һ�����¡��ɺ�����NaCO2��ء��ŵ�ʱ�õ�ء����롱CO2 �� ���ʱ��������CO2������CO2ʱ���乤��ԭ������ͼ��ʾ�����յ�ȫ��CO2�У���2/3ת��ΪNa2CO3��������ڶ��̼���ܣ�MWCNT���缫���档����˵����ȷ���ǣ�( )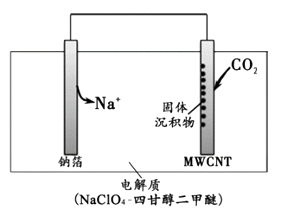
A.�����롱CO2ʱ���Ʋ�Ϊ����
B.��������CO2ʱ��Na+����̼���ܵ缫�ƶ�
C.�����롱CO2ʱ��������Ӧ��4Na+ + 3CO2 + 4e-= 2Na2CO3 + C
D.��״���£�ÿ��������22.4LCO2 �� ת�Ƶ�����Ϊ0.75mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA+B��C���������У���A+B��X����X��C����Ӧ�����������仯��ͼ��ʾ��E4��ʾ��ӦA+B��X�Ļ�ܣ������й�������ȷ���ǣ� �� 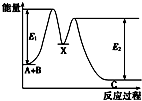
A.Ee��ʾ��ӦX��C�Ļ��
B.X�Ƿ�ӦA+B��C�Ĵ���
C.��ӦA+B��C�ġ�H��0
D.��������ɸı䷴ӦA+B��C���ʱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������������(����������������)������������Ʒ�Ĺ�ҵ�������£�
��1������I��������Ӧ�����ӷ���ʽ����
��2������II����һ��Ũ�ȵ�NaHCO3��Һ�����������Һ��������ҺpH��Al(OH)3���ɵ��������NaHCO3��Һ����仯���������£�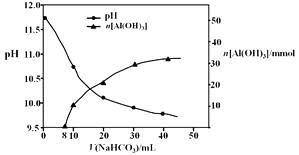
�� ����NaHCO3��Һ���С��8 mLʱ��������Ҫ��Ӧ�����ӷ���ʽ����
�� ����II����Al(OH)3�����ӷ���ʽ����
��3������III�����Na2CO3��Һ��װ������ͼ��ʾ��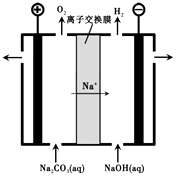
�������ĵ缫��Ӧʽ����
�ڼ�������Һ���ɵ�ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ҫ�ɷ֣�Fe3O4��Fe2O3��FeO���õ��̷�����FeSO47H2O������ͨ���̷��Ʊ�����[FeO��OH��]���������£����� ![]() ��Һ
��Һ ![]() �̷�
�̷� ![]() ���� ��֪��FeS2�����ƾ�������ˮ����˵������ȷ���ǣ�������
���� ��֪��FeS2�����ƾ�������ˮ����˵������ȷ���ǣ�������
A.����٣�������������ܽ�����
B.����ڣ��漰�����ӷ�ӦΪFeS2+14Fe3++8H2O�T15Fe2++2SO42��+16H+
C.����ۣ�����Һ���ȵ��н϶�����������������Ƚ�Һ�����ɣ��ɵô����̷�
D.����ܣ���Ӧ�������Ʋ�����ʹ�����л���Fe��OH��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���о��к���ɫ����������Աȷ������Ľ��۲���ȷ���ǣ�������
|
|
|
�� | �� | �� |
A.�ɢ��еĺ���ɫ���壬�ƶϲ���������һ���ǻ������
B.����ɫ���岻�ܱ�������ľ̿��Ũ��������˷�Ӧ
C.�ɢ�˵��Ũ������лӷ��ԣ����ɵĺ���ɫ����Ϊ��ԭ����
D.�۵���������м���CO2 �� �ɴ�˵��ľ̿һ����Ũ���ᷢ���˷�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com