
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如图所示.下列说法正确的是( ) 
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则 ![]() 增大
增大
【答案】C
【解析】解:室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,HA溶液PH=5,说明HA为强酸,HB为弱酸;
A.pH均为2的两种一元酸HA和HB各1mL,分别加水稀释1000倍,HA溶液PH=5,HB溶液PH小于5,HA的酸性比HB的酸性强,故A错误;
B.a点溶液中离子浓度大于c点溶液中离子浓度,溶液导电性取决于离子浓度大小,则a点溶液的导电性比c点溶液的导电性强,故B错误;
C.溶液无限稀释接近为水的电离,氢离子浓度接近为10﹣7 , 若两溶液无限稀释,则它们的c(H+)相等,故C正确;
D.HA为强酸,HB为弱酸,对a、b两点溶液同时升高温度,c(A)浓度不变,HB电离程度增大,c(B)浓度增大, ![]() 比值减小,故D错误,故D错误;
比值减小,故D错误,故D错误;
故选C.
【考点精析】根据题目的已知条件,利用弱电解质在水溶液中的电离平衡的相关知识可以得到问题的答案,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】某同学利用右图所示装置制备乙酸乙酯。实验如下:( )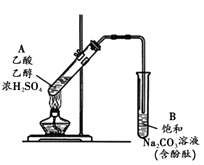
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A.①中加热利于加快酯化反应速率,故温度越高越好
B.③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C.③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D.取②中上层油状液体测其,共有3组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( ) 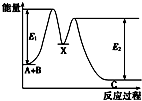
A.Ee表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
(1)过程I,发生反应的离子方程式是。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下: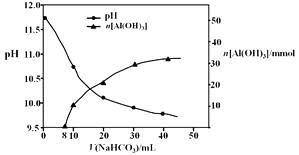
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是。
② 过程II生成Al(OH)3的离子方程式是。
(3)过程III,电解Na2CO3溶液的装置如下图所示。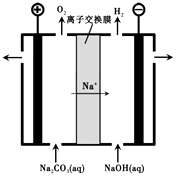
①阴极的电极反应式是。
②简述阳极液生成的原理:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验铵盐的方法中,正确的是
A.加入氢氧化钠溶液,加热试管,再滴入酚酞试液
B.加入氢氧化钠溶液,加热试管,并用湿润的红色石蕊试纸接近试管口上方
C.加热试管,并用湿润的红色石蕊试纸接近试管口上方
D.加水溶解,再用红色石蕊试纸检验其溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(主FeSO47H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:烧渣 ![]() 溶液
溶液 ![]() 绿矾
绿矾 ![]() 铁黄 已知:FeS2和铁黄均难溶于水下列说法不正确的是( )
铁黄 已知:FeS2和铁黄均难溶于水下列说法不正确的是( )
A.步骤①,最好用硫酸来溶解烧渣
B.步骤②,涉及的离子反应为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+
C.步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D.步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
(1)NO的体积为L,NO2的体积为L.
(2)将产生的气体全全释放后,向溶液中加入VmLamolL﹣1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为molL﹣1 .
(3)若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com