
【题目】下列各物质属于电解质的是
①NaOH②BaS04③Cu④蔗糖⑤C02
A.①② B.①②⑤ C.③④ D.①③⑤
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】某废液是用稀硝酸腐蚀锌板后得到的 ,某化学兴趣小组拟用该废液(含有少量的Cl-、Fe3+)制取Zn(NO3)2·6H2O的过程如下:
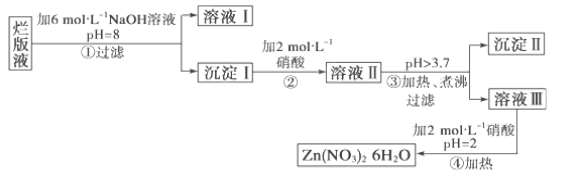
已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物Zn(OH)2具有两性,Fe3+在PH=3.7时就能完全沉淀。
(1)该废液溶质的主要成分是________(填化学式)。
(2)在操作①中保持pH=8的目的是______________________。
(3)沉淀Ⅰ的成分是___________________________。
(4)操作③中加热、煮沸的目的是________________________;
(5)操作④保持pH=2的目的是__________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构为:有关原花青素的下列说法不正确的( )
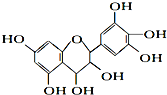
A.该物质既可看作醇类,也可看作酚类
B.1mol该物质可与4mol Br2反应
C.1mol该物质可与7mol Na反应
D.1mol该物质可与7mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
Ⅰ.第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
镓(31Ga)的基态电子排布式是 ;
31Ga的第一电离能却明显低于30Zn,原因是 ;
Ⅱ.第四周期过渡元素的明显特征是形成多种多样的配合物。
(1)CO和NH3可以和很多过渡金属形成配合物。CO与N2互为等电子体,CO分子中C原子上有一孤电子对,C、O原子都符合8电子稳定结构,则CO的结构式可表示为 。NH3 分子中N原子的杂化方式为 杂化,NH3分子的空间立体构型是 。
(2)向盛有硫酸铜水溶液的试管中加氨水,首先形成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加乙醇,析出深蓝色晶体。蓝色沉淀先溶解,后析出的原因是: (用相关的离子方程式和简单的文字说明加以解释)
(3)图甲所示的二维平面晶体示意图中表示化学式为AX3的是________。
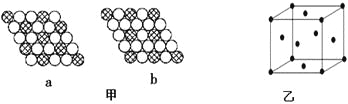
(4)图乙为一个金属铜的晶胞,此晶胞立方体的边长为acm,Cu的相对原子质量为64,金属铜的密度为ρ g/cm3,则阿伏加德罗常数可表示为 mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组微粒:
A.12C和14C B.O2和O3
C.H、D、T D.金刚石和石墨
E.CH3OH和![]()
F. 和
和![]()
用序号填空:
(1)互为同位素的是______;
(2)互为同素异形体的是______;
(3)互为同分异构体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:

(1)在这些元素中,化学性质最不活泼的是______(填元素符号,下同)。
(2)从①到③的元素中,非金属性最强的是_____。
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式是______,碱性最强的化合物的电子式是______。
(4)最高价氧化物是两性氧化物的元素是______;写出它的最高价氧化物与氢氧化钠反应的离子方程式______________________。
(5)用结构式表示元素①与③形成的一种可溶于水的化合物_____,该化合物的常见固体是______晶体。
(6)写出元素④的单质与水反应的化学方程式_________________。
(7)写出元素①的单质和元素⑥最高价氧化物对应水化物的浓溶液反应的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
⑴H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)= H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_____________。
⑵20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2的技术:将烟气预氧化使SO2转化为SO3,再将预氧化后的烟气利用如图所示原理净化利用。
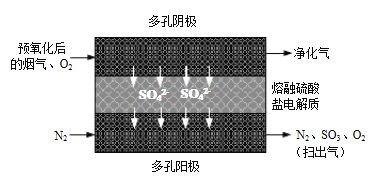
①阴极反应方程式为_____________。
②若电解过程中转移1mol电子,所得“扫出气”用水吸收最多可制得质量分数70%的硫酸_____________g。
⑶利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。
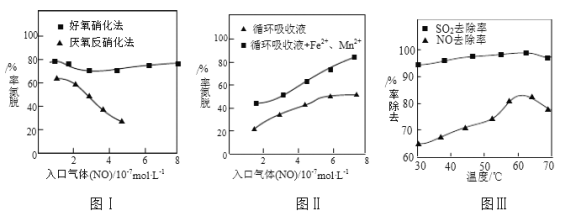
①由图I知,当废气中的NO含量增加时,宜选用____________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为_____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率随温度升高而下降的原因为_____________。
②写出废气中的SO2与NaClO2反应的离子方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com