
【题目】硫酸铜晶体(CuSO4·![]() H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量
H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量![]() 的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
坩埚质量 | 坩埚和晶体的质量 | 完全失去结晶水后坩埚和剩余固体的质量 |
11.685g | 13.691g | 12.948g |
(1)要完成此实验,至少要称量______次。
(2)![]() ______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
(3)造成本次误差可能的原因是______。
A. 加热时有晶体溅出
B. 实验前坩埚内有受热不挥发、不分解也不与硫酸铜反应的杂质
C. 粉末未完全变白就停止加热
D. 加热后放在空气中冷却
(4)请写出造成本次误差还有可能存在的其他原因(写出其中一点)_____________________。
(5)如果硫酸铜晶体样品不纯,测定结果________。
A.没有偏差 B. 一定偏小 C. 一定偏大 D. 无法确定
【答案】4 5.21 偏高 A 加热时间过程,晶体部分变黑 D
【解析】
在CuSO4晶体结晶水测定的实验中至少4次称量;
根据结晶水合物中,结晶水的质量=m(硫酸铜晶体)m(无水硫酸铜),依据化学方程式可以计算结晶水的值;
实验误差=![]() ×100%;
×100%;
坩埚湿、晶体溅出、硫酸铜分解都会导致加热前后固体的质量差偏大;
硫酸铜晶体样品不纯,可能含有易挥发的杂质,也可能含有不易挥发的杂质,据此分析。
(1)在CuSO4晶体结晶水测定的实验中至少4次称量,分别为:坩埚质量、坩埚和样品质量、灼烧后坩埚和样品质量、再灼烧后坩埚和样品质量,
故答案为:4;
(2)硫酸铜晶体的质量为13.691g-11.685g=2.006g,硫酸铜的质量为12.948-11.685=1.263g,所以结晶水的质量为2.006-1.263=0.743g;
CuSO4![]() xH2O= CuSO4
xH2O= CuSO4![]() +xH2O
+xH2O
159.5 18x
1.263g 0.743g
![]() =
=![]() ,解得x≈5.21;
,解得x≈5.21;
实验误差=![]() ×100%=4.20%,误差为正值,即偏高;
×100%=4.20%,误差为正值,即偏高;
故答案为:5.21;偏高;
(3) A.加热过程中晶体有少量溅失,造成加热前后固体的质量差偏大,测定结果偏高;
B. 实验前坩埚内有受热不挥发、不分解也不与硫酸铜反应的杂质,只有其中的硫酸铜晶体分解,造成加热前后固体的质量差偏小,使测定结果偏低;
C. 粉末未完全变白就停止加热,造成加热前后固体的质量差偏小,使测定结果偏低;
D. 加热后放在空气中冷却,吸收空气中的水分,造成加热前后固体的质量差偏小,使测定结果偏低。
故答案选:A;
(4) 加热时间过程,晶体部分变黑,也会造成加热前后固体的质量差偏大,测定结果偏高;
故答案为:加热时间过程,晶体部分变黑;
(5)如果硫酸铜晶体样品不纯,可能有两种情况:一是硫酸铜晶体样品中含有易挥发杂质,造成加热前后固体的质量差偏大,使测定结果偏高;二是硫酸铜晶体样品中含有细沙等不易挥发杂质,加热后不挥发性杂质不分解,只有其中的硫酸铜晶体分解,造成加热前后固体的质量差偏小,使测定结果偏低,所以无法确定,故选D。
故答案选:D。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,发现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
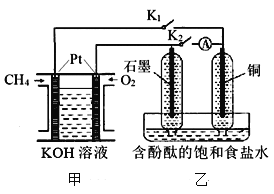
A. 断开K2,闭合K1时,石墨电极上的电极反应式为:2 H++ 2e-=H2↑
B. 断开K1,闭合K2时,铜电极上的电极反应式为:Cl2 + 2e-=2Cl-
C. 甲装置属于燃料电池,该电池正极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O
D. 甲烷燃料电池的总电极反应式为:CH4+2O2 +2NaOH=Na2CO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连
B.将1 mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2×6.02×1023
C.常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值增大
的值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
CO2(g)+4H2(g) ΔH3 = +a kJ·mol-1
化学键 | C—H | H—H | H—O |
键能kJ/mol | b | c | d |
(1)写出甲烷的结构式___________
(2)C=O的键能为_______________kJ/mol (用含a、b、c、d的式子表示)
(3)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应。测得甲烷物质的量随时间变化如下表所示。0~10min内用H2O的浓度表示该反应的平均速率为ν(H2O)= _____________
时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
(4)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是_______________。
a.混合气体的平均相对分子质量保持不变 b.CO2和H2的体积分数比为1﹕4
c.混合气体的密度保持不变 d.1mol CO2生成的同时有4mol H-H键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C物质为烃类,在标准状况下的密度为1.16g/L,F物质具有水果香味,G物质不能水解。转化关系如图所示,省略了反应条件。

请回答下列问题:
(1)写出G的分子式:____________________。
(2)D中官能团的名称是__________________________。 C→A的反应类型____________
(3)请写出反应B+E→F的化学方程式:______________________。
(4)下列有关说法正确的是_____________________________。
A.C物质燃烧时,易产生大量黑烟 B.物质B和甘油( )互为同系物
)互为同系物
C.一定条件下,A可被直接氧化为D D.用NaOH溶液可以区分B、D、F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:

(1)写出③、⑤两种元素形成的化合物有两种,电子式分别是:__,___。
(2)写出①元素形成最简单有机物是__,它和氯气反应的一个方程式__。
(3)这些元素的最高价氧化物的对应水化物中__酸性最强;__碱性最强;能形成两性氢氧化物的元素是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。2017年5月9日,中国公布113号、115号、117号和118号四种元素的中文名称。其中118号元素的原子符号为![]() Og,中文名称为“
Og,中文名称为“![]() ”下列说法不正确的是
”下列说法不正确的是
A. 质子数为118B. 中子数为176
C. 核外电子数为118D. 质量数为412
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】线型PAA(![]() )具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如下:
)具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如下:
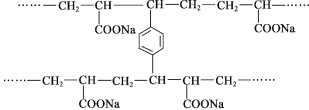
下列说法不正确的是( )
A. 线型PAA的单体不存在顺反异构现象
B. 交联剂a的结构简式是![]()
C. 形成网状结构的过程发生了加聚反应
D. PAA的高吸水性与—COONa有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A. 达到平衡后,升高温度有利于该反应平衡正向移动
B. 达到化学平衡时,v正(A2)=2v逆(B2)
C. 升高温度,正向反应速率增加,逆向反应速率减小
D. 达到平衡后,降低温度A2气体的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com