
【题目】已知反应:A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A. 达到平衡后,升高温度有利于该反应平衡正向移动
B. 达到化学平衡时,v正(A2)=2v逆(B2)
C. 升高温度,正向反应速率增加,逆向反应速率减小
D. 达到平衡后,降低温度A2气体的转化率增大
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4·![]() H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量
H2O蓝色)在110℃开始失去结晶水,150℃失去全部结晶水,生成白色的无水硫酸铜。依据硫酸铜晶体受热失去结晶水的事实,可以设计硫酸铜晶体水含量![]() 的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
的测定方法。请根据以下实验数据回答相关问题:(M(CuSO4)=159.5g/mol、M(H2O)=18.0g/mol)
坩埚质量 | 坩埚和晶体的质量 | 完全失去结晶水后坩埚和剩余固体的质量 |
11.685g | 13.691g | 12.948g |
(1)要完成此实验,至少要称量______次。
(2)![]() ______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
______(保留2位小数),本次实验结果____(填“偏高”、“偏低”)。
(3)造成本次误差可能的原因是______。
A. 加热时有晶体溅出
B. 实验前坩埚内有受热不挥发、不分解也不与硫酸铜反应的杂质
C. 粉末未完全变白就停止加热
D. 加热后放在空气中冷却
(4)请写出造成本次误差还有可能存在的其他原因(写出其中一点)_____________________。
(5)如果硫酸铜晶体样品不纯,测定结果________。
A.没有偏差 B. 一定偏小 C. 一定偏大 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝试剂:(NH4)3C19H8(OH)3(COO)3,其商品名为阿罗明拿,可用来鉴定溶液中的铝离子。请回答下列问题:
(1)碳原子价层电子的电子排布图_______。
(2)第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是____________;氮元素的第一电离能呈现异常的原因是____。
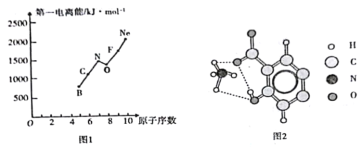
(3)经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为_________,不同之处为_________。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为_______个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为______________。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、____________、____________。
(4)阿罗明拿的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为______________(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,NOx和SO2是雾霾的主要成分。
Ⅰ. NOx主要来源于汽车尾气,可以利用化学方法将二者转化为无毒无害的物质。
已知:N2(g)+O2(g) ![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-564 kJ·mol-1
2CO2(g) ΔH=-564 kJ·mol-1
(1)2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=________.
2CO2(g)+N2(g) ΔH=________.
(2)T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,保持温度和体积不变,反应过程(0~15 min)中NO的物质的量随时间变化如图所示。
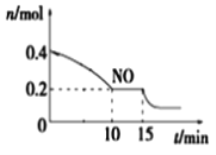
①已知:平衡时气体的分压=气体的体积分数×体系的总压强,T℃时达到平衡,此时体系的总压强为p=20MPa,则T℃时该反应的压力平衡常数Kp =_______;平衡后,若保持温度不变,再向容器中充入NO和CO2各0.3mol,平衡将_____ (填“向左”、“向右”或“不”)移动。
②15 min时,若改变外界反应条件,导致n(NO)发生如上图所示的变化,则改变的条件可能是_____(填序号)
A.增大CO浓度 B.升温 C.减小容器体积 D.加入催化剂
Ⅱ. SO2主要来源于煤的燃烧。燃烧烟气的脱硫减排是减少大气中含硫化合物污染的关键。
已知:亚硫酸:Ka1=2.0×10-2 Ka2=6.0×10-7
(3)请通过计算证明,NaHSO3溶液显酸性的原因:_________________________
(4)如图示的电解装置,可将雾霾中的NO、SO2转化为硫酸铵,从而实现废气的回收再利用。通入NO的电极反应式为____________________;若通入的NO体积为4.48L(标况下),则另外一个电极通入的SO2质量至少为________g。
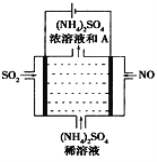
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.NaHCO3在水中的电离方程式:NaHCO3 = Na++HCO![]()
B.氯化镁溶液与氨水反应的离子方程式:Mg2++2OH-= Mg(OH)2↓
C.Cl2与水反应的离子方程式:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
D.醋酸钠水解的离子方程式CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨气燃料电池,如图所示,下列说法不正确的是
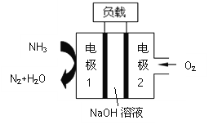
A.正极的电极反应式为O2+4e-+4H+=2H2O
B.电子流向:电极1→负载→电极2
C.Na+由左向右移动
D.NH3在电极1上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下,用O2氧化a mol/L FeCl2溶液过程中所测的实验数据如图所示。
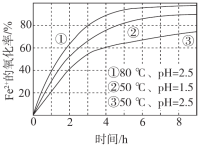
4Fe2+(aq)+4H+(aq)+O2(g)=4Fe3+(aq)+2H2O(l) ΔH>0
下列分析或推测合理的是
A.由①、②可知,pH越大,Fe2+越易被氧化
B.由②、③推测,若pH>7,Fe2+更难被氧化
C.pH=2.5、70℃时,0~3 h内Fe2+的平均消耗速率ν(Fe2+) < ![]() mol/(L·h)
mol/(L·h)
D.曲线②的变化趋势推测,反应吸热使得溶液温度下降,反应速率下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)ΔH3=+akJ·mol-1
CO2(g)+4H2(g)ΔH3=+akJ·mol-1
化学键 | C—H | H—H | H—O |
键能kJ/mol | b | c | d |
(1)写出甲烷的结构式___________
(2)C=O的键能为_______________kJ/mol(用含a、b、c、d的式子表示)
(3)恒温条件下,在体积恒为0.5L的密闭容器中通入一定量甲烷和水蒸气,发生上述反应。测得甲烷物质的量随时间变化如下表所示。0~10min内用H2O的浓度表示该反应的平均速率为υ(H2O)=_____________
时间/min | 0 | 10 | 20 | 40 | 50 | 60 |
n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 | 0.10 |
(4)恒温恒容情况下,下列叙述能说明此反应达到平衡状态的是_______________。
a.混合气体的平均相对分子质量保持不变b.CO2和H2的体积分数比为1﹕4
c.混合气体的密度保持不变d.1molCO2生成的同时有4molH-H键断裂
(5)写出甲烷燃料电池,以KOH溶液为介质时,负极的电极反应式______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验探究工业制乙烯的原理和乙烯主要的化学性质,实验装置如图所示。
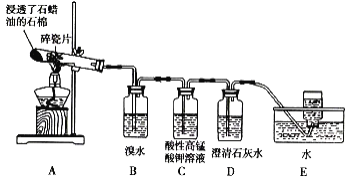
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热、加压条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷可发生如下反应,反应式已配平:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为______;乙的结构简式为____。
4乙,则甲的分子式为______;乙的结构简式为____。
(2)B装置中的实验现象是______。
(3)C装置中的实验现象是_____,其中发生反应的反应类型是___。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_(填序号)中的实验现象可判断该资料是否真实。
(5)通过题述实验探究可知,检验甲烷和乙烯的方法是_____(填序号,下同);除去甲烷中乙烯的方法是____。
A.气体通入水中 B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,乙烯产生黑烟,原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com