
| A、计算机芯片的组成元素位于第14列 |
| B、元素周期表共有7个周期,16个族 |
| C、每一周期的元素都是从碱金属开始,最后以稀有气体结束 |
| D、第二、三周期中,同一列上下相邻元素的原子核外电子数相差8个 |


科目:高中化学 来源: 题型:
| A、常温常压下,9gH2O含有分子数为0.5NA |
| B、标准状况下,以任意比例混合的甲烷和丙烷(C3H8)的气体混合物11.2L,则所含有的分子数为NA |
| C、常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA |
| D、物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验及现象 | 理论解释 |
| A | 向等体积等浓度的Na2CO3和NaHCO3溶液中分别滴加酚酞溶液,前者溶液红色更深 | Na2CO3比NaHCO3的溶解度大 |
| B | 向等体积混合的AgCl与AgI的饱和溶液中滴加足量浓AgNO3溶液,生成沉淀AgI多于AgCl | AgI比AgCl的溶解度更小,更容易沉淀 |
| C | 将绿豆粒大小的钠加入到乙醇中,钠在液面上剧烈反应 | 钠的密度小于乙醇,钠能置换出醇羟基中的氢,生成了氢气 |
| D | 向盛有经打磨的铝片的试管中加入5mL 6mol?L-1盐酸,气泡生成速率先加快后减慢 | 反应放热致温度升高是速率先加快的主要原因;c(H+)降低是速度后减慢的主要原因 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
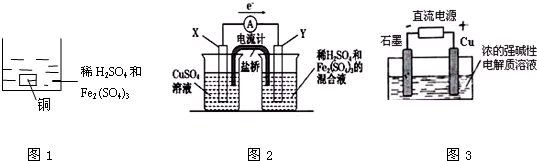
| A、如图1所示将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合溶液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶液中c(SO42-)为0.5mol/L |
| B、如图2所示的装置中发生Cu+2Fe3+═Cu2++2Fe2+的反应,X极是负极,Y极的材料可以是铜 |
| C、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图3所示,石墨电极上产生氢气,铜电极发生还原反应 |
| D、如图3所示,当有0.1mol电子转移时,有0.1mol Cu2O生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、③④ | C、①③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油燃烧产生的尾气中,含有碳的氧化物、氮的氧化物等污染物 |
| B、我国许多城市已经推广使用清洁燃料,如压缩天然气(CNG)类、液化石油气(LPG)类,这两类燃料的主要成分都是烃类 |
| C、光束通过下列分散系①有尘埃的空气②Fe(OH)3胶体③墨水④稀豆浆时,都能产生丁达尔效应 |
| D、114号元素在周期表中第七周期第ⅥA族,属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3 mol?L-1 |
| B、Y2为0.35 mol?L-1 |
| C、X2为0.2 mol?L-1 |
| D、Z为0.35 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、目前治理白色污染的方法主要是减少使用、加强回收 |
| B、少量钠、钾要在干燥的试剂瓶中保存妥善保管 |
| C、废旧电池应集中回收进行填埋处理 |
| D、柠檬是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com