
【题目】在一定体积的容器中加入1.5mol氙气和7.5mol氟气,于400℃和2633Kpa压强下加热数小时,然后迅速冷至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气。则所得无色晶体产物中,氙和氟的原子个数之比是 ( )
A.1 :6B.1 :4C.1 :3D.1 :2
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含有少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)“熔融”时ZrSiO4发生反应的化学方程式为________________________________。
(2)“滤渣Ⅰ”的化学式为________________。
(3)为使滤液Ⅰ中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________。
(4)向“过滤Ⅲ”所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
(1)相同温度下等物浓度的下列溶液中. A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是(用对应的字母填写).
②NH4+离子浓度由大到小的顺序是(用对应的字母填写).
③若上述溶液的pH值相同,则其物成的量浓度关系是(用对应的字母填写).
(2)25℃.向50mL 0.018molL﹣1 的 AgNO3溶液中加入50mL 0.020molL﹣1的盐酸,生成沉淀.己知该温度下AgCl的Ksp=1.0×10﹣10 , 忽略溶液的体积变化,请计算: ①完全沉淀后,溶液中c(Ag+)= .
②完全沉淀后,溶液的pH= .
(3)弱酸及其盐在水中存在多种平衡关系.己知NaA水溶液呈碱性,常温下将0.1molNaA和0.05molHCl溶于水,得到1L溶液. ①己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为 .
②向该混合物中再加0.03molNaOH,溶液中n(A﹣)+n(OH﹣)﹣n(H+)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g).若经2s后测得C的浓度为0.6molL﹣1 , 现有下列几种说法:其中正确的是( ) ①用物质A表示的反应的平均速率为0.3molL﹣1s﹣1
②用物质B表示的反应的平均速率为0.6molL﹣1s﹣1
③2s时物质B的浓度为0.7molL﹣1
④2s末,物质A的转化率为70%
A.①④
B.①③
C.②④
D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和O2。下列说法中正确的是

A. 该电池放电时,Li+向电极X方向移动
B. 该电池充电时,电极Y与外接直流电源的负极相连
C. 该电池放电时,每转移4 mol电子,理论上生成1mol C
D. 该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(资治通鉴·后晋高祖天福二年)有言:“闽主作紫微官,饰以水晶”。下列关于水晶主要成分的说法正确的是
A. 是一种硅酸盐 B. 分子式为SiO2
C. 是酸性氧化物,不溶于任何酸 D. 在高温条件下可与碳酸钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的一部分,根据①~⑨在周期表中的位置,用元素符号或化学式回答下列问题:
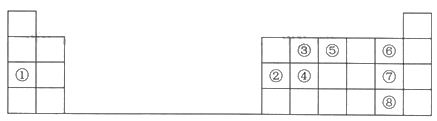
(1)元素④在元素周期表中的位置为________。
(2)最高价氧化物的水化物中碱性最强的物质的电子式为________。
(3)写出②和⑦两种元素的最高价氧化物的水化物相互反应的化学方程式:_______。
(4)④、⑤、⑥三种元素按原子半径由大到小的顺序排列为_______。
(5)③和⑦两种元素形成的简单化合物的结构式为_______,空间构型为________。
(6)设计实验探究⑦、⑧两种元素非金属性的相对强弱。
可选用的试剂有:氯水、NaBr溶液、AgNO3溶液、苯。
请完成实验报告单。
步骤一 | 步骤二 | |
实验内容 | 试管1:取少量氯水; 试管2:取少量氯水,滴加少量NaBr溶液。 | 分别向试管1、试管2中加少量______(填试剂),振荡,静置。 |
实验现象 | 试管2中的现象是______。 | 试管2中的现象是_______。 |
实验分析 | 试管1的作用是_____。 | 试管2中反应的离子方程式为_____,此实验的结论是_____。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,在850℃时,平衡常数K=1.现在850℃时,向2L的密闭容器中充入CO、H2O(g)各4mol,试回答下列问题(写出具体的计算过程):
(1)达平衡时,CO转化率为多少?
(2)H2的体积分数为多少?
(3)若温度仍为850℃,初始时CO浓度为2mol/L,H2O(g)为6mol/L,则平衡时CO转化率为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com