
| A、所失去的电子数比是3:3:2 |
| B、质量相等 |
| C、物质的量相等 |
| D、质量比是28:12:9 |
| x |
| 56 |
| y |
| 24 |
| z |
| 27 |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.4g NaHCO3固体中含有0.1NA个CO32- |
| B、1 mol CH3Cl中所含的共价键数为4NA |
| C、常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子 |
| D、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
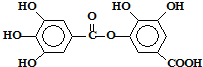 ,关于它的性质的叙述中不正确的是( )
,关于它的性质的叙述中不正确的是( )| A、它可以水解,水解产物只有一种 |
| B、1mol该有机物最多能和8molNaOH反应 |
| C、1mol该有机物最多能和4molBr2发生反应 |
| D、1mol该有机物最多能和8molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列实验操作或描述中正确的是( )
下列实验操作或描述中正确的是( )| A、①②⑤ | B、③⑤⑥ |
| C、①②④ | D、③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、NO3-、Cl- |
| B、NH4+、K+、CH3COO-、SO42- |
| C、Ca2+、Br-、SO42-、Al3+ |
| D、Fe2+、OH-、MnO4-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| c(CO) |
| c(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com