
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
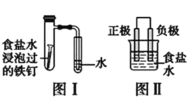
A.按图Ⅰ装置实验,加热具支试管可更快更清晰地得到实验证据—观察到液柱上升
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面白斑可用图Ⅲ装置进行探究,Cl-在铝箔表面区发生电极反应:2Cl- -2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3脱水形成白斑
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)___________种。
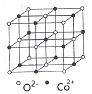
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。向滤液中滴加 2mol·L-1的 NaOH溶液至40mL时开始出现沉淀。则未滴加 NaOH溶液前,滤液中 FeSO4的物质的量浓度为
A.2 mol·L-1B.l.8 mol·L-1C.1.9 mol·L-1D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下装置进行铁与水反应的实验,虚线框处的装置用来检验生成的气体。下列说法正确的是(已知:Fe + 2Fe3+ = 3Fe2+)
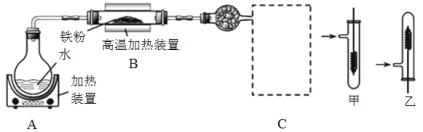
A.实验后,装置B中生成红棕色固体
B.虚线框C处应该选择装置甲
C.实验时将螺旋状铜丝加热变黑后再趁热迅速伸入试管中,可观察到铜丝由黑变红
D.实验后,将装置B中的固体溶于足量稀硫酸,所得溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下1mol某烃完全燃烧时,生成89.6LCO2,又知0.1mol此烃能与标准状况下4.48LH2加成,则此烃的结构简式是
A.CH3CH=CHCH3B.CH3C≡CCH3
C.CH3CH2CH=CH2D.CH2=CHCH=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理应用广泛。
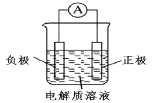
(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱。
如图所示,该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。写出该氧化还原反应的离子方程式:__________________________,装置中的负极材料是______(填化学式),正极反应式是_________________________。
(2)某研究性学习小组为证明2Fe3++2I-![]() 2Fe2++I2为可逆反应,设计如下方案:组装如图原电池装置,接通灵敏电流计,指针向右偏转(注:此灵敏电流计指针是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/LFeCl2溶液。
2Fe2++I2为可逆反应,设计如下方案:组装如图原电池装置,接通灵敏电流计,指针向右偏转(注:此灵敏电流计指针是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/LFeCl2溶液。
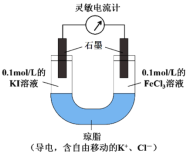
①实验中,“读数变为零”是因为___________________。
②“在右管中加入1mol/LFeCl2溶液”后,观察到灵敏电流计的指针_________偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲制取氨气设计了如下图所示装置(另有橡胶管若干可选用)。
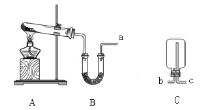
(1)A中制氨气的化学方程式是____________________________________。
(2)B中应装___________,作用是____________。
(3)收集氨气时,B装置的a口应连接C装置的___________(填“b”或“c”)口;证明氨气已集满的操作和现象是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2V L含有Na2SO4和MgSO4的混合溶液分成两等份,一份加入含溶质a mol的KOH溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含溶质b mol的BaCl2溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钠离子的浓度为
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)CuCl2溶液显_____性,理由是(用离子方程式表示)____________
(II)BaSO4浊液中存在______平衡,其表达式为:__________________
(III)已知:①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1=﹣1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H2=﹣566.0kJ/mol,
③H2O(g)═H2O(l)△H3=﹣44.0kJ/mol
上述三个反应中,△S<0的是___________.甲醇燃烧生成一氧化碳和液态水的热化学方程式是______________________
(IV)已知碳酸H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11
草酸H2C2O4:Ka1=5.9×10-2,Ka2=6.4×10-5,0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”),等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是_____。(选填编号)
A.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
B.c(HCO3-)>c(HC2O4-)c(C2O42-)>c(CO32-)
C.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
D.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com