
【题目】(化学——选修3:物质结构与性质)
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)___________种。
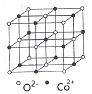
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿伏加德罗常数为NA)。
【答案】1s22s22p63s23p63d74s2或[Ar]3d74s2 3 高于 H2O分子间可形成氢键,而H2S分子间无氢键 sp3 极性 6 八面体 5 12 ![]()
【解析】
(1)钴元素为第27号元素,根据构造原理,其基态原子核外的电子排布式为:1s22s22p63s23p63d74s2或[Ar]3d74s2;其3d轨道上有3个未成对电子,故未成对电子数为3;
(2)①H2O的沸点高于H2S,原因是H2O分子间可形成氢键,而H2S分子间无氢键;H2O的中心原子O的成键电子对数为2,未成对电子数为:![]() =2,故氧原子的杂化方式为sp3;H2O的空间结构为V型,其正负电荷中心不重叠,故属于极性分子;
=2,故氧原子的杂化方式为sp3;H2O的空间结构为V型,其正负电荷中心不重叠,故属于极性分子;
②在配合物[Co(NH3)4(H2O)2]Cl3中,配体为NH3、H2O,其配位数=4+2=6;其阳离子的成键电子对数为6,孤电子对数为0,故其立体构型为八面体;若[Co(NH3)4(H2O)2]Cl3其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的结构可通过下列方法解答:[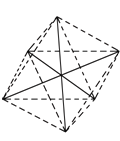 (正八面体构型)],两个NH3分子分别被Cl-和H2O取代,形成[Co(NH3)2Cl2(H2O)2]3+,六个顶点,有三种基团,设为ABC,第一类是相同基团以Co原子为对称中心,不考虑光学异构,只有一种;第二类,以第一种为原型上下顶点不变,只改变正方形,只有一种变化,即原来正方形中的相同基团相邻了,因为有三种基团,所以该类有三种几何异构体;第三类,所有相同的基团都相邻,不考虑光学异构,也只有一种异构体。综上所述,共有5种几何异构体;
(正八面体构型)],两个NH3分子分别被Cl-和H2O取代,形成[Co(NH3)2Cl2(H2O)2]3+,六个顶点,有三种基团,设为ABC,第一类是相同基团以Co原子为对称中心,不考虑光学异构,只有一种;第二类,以第一种为原型上下顶点不变,只改变正方形,只有一种变化,即原来正方形中的相同基团相邻了,因为有三种基团,所以该类有三种几何异构体;第三类,所有相同的基团都相邻,不考虑光学异构,也只有一种异构体。综上所述,共有5种几何异构体;
(3)由CoO的晶胞结构可知,每个Co2+的周围与它最接近的且距离相等的Co2+共有12个;若晶体中Co2+与O2-的最小距离为acm,即该晶胞的边长为2acm,其体积为8a3cm3,该晶胞含有4个CoO“分子”,其质量为![]() g,其密度
g,其密度 =
=![]() g/cm3。
g/cm3。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________口进水。装置B在分液时为使液体顺利滴下,除打开活塞外,还应进行的具体操作是____。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④调节溶液的pH等于7 ⑤溶解 ⑥过滤 ⑦蒸发
正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).FeCl3是中学实验室常用的试剂,可以用来制备氢氧化铁胶体。
下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
A.向饱和氯化铁溶液中滴加少量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至液体呈红褐色。
(2)写出Ba(OH)2溶液与少量NaHCO3溶液反应的离子方程式:___________________。
(3)写出次氯酸的电子式:________________;写出过氧化钠中存在的所有化学键类型:____________________。
(4)铁粉中含有铝粉,可加______除去杂质,发生的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿( 主要成分为FeTiO3 和少量Fe2O3 )进行钛白粉和LiFePO4 的联合生产工艺如下图所示:
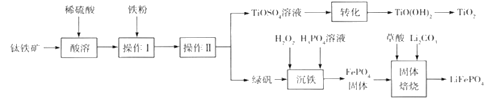
回答下列问题:
(1) LiFePO4中Fe的化合价是_______________________。
(2)钛铁矿“酸溶”前需要进行粉碎,粉碎的目的是__________________________________。
(3)用离子方程式表示操作I加入铁粉的目的:__________________________。操作II为一系列操作,名称是加热浓缩、冷却结晶、过滤,其中用到的陶瓷仪器的名称是___________。
(4)TiO2+易水解,则其水解的离子方程式为______________________;“转化”利用的是TiO2+的水解过程,需要对溶液加热,加热的目的是________________________________。
(5)“沉铁”的的是使Fe3+生成FePO4,当溶液中c(PO43-)= 1.0×10-17mol/L时可认为Fe3+ 沉淀完全,则溶液中Fe3+沉淀完全时的c(Fe3+)=_______mol/L[已知:该温度下,Ksp(FePO4)=1.0×10-22]。
(6)由“沉铁”到制备LiFePO4的过程中,所需17% H2O2溶液与草酸( H2C2O4)的质量比是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用AG表示溶液的酸度,其表达式为AG=lg[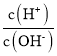 ],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
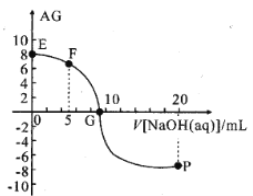
A.溶液pH和AG的关系式为AG=14-2pH
B.对G点溶液,c(Na+) = c(X-)
C.298K时HX的电离常数Ka≈1.0×10-5
D.溶液中水电离的c(OH-) F点<P点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。查阅资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。②Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成 KC1O3。
(1)用K2FeO4处理生活用水既可以消毒又可以沉降,其原理是K2FeO4与水反应生成Fe(OH)3 胶体,写出该反应的离子方程式:____________________________。
(2)实验室常利用氯气制备NaClO后与NaOH、Fe(NO3)3反应制备K2FeO4根据反应原理,仅根据下列仪器,请你组装合理、简洁的实验装置,所用的装置的接口连接顺序:___________________________。
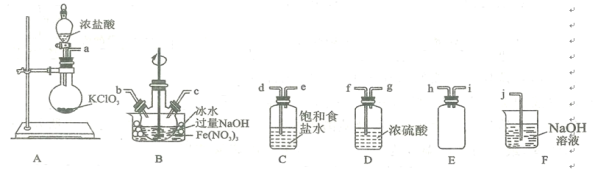
(3)写出装置A中发生的离子方程式: ______________________ 。
(4)三颈烧瓶用冰水浴的原因是 _________________,A处盛放KC1O3的仪器名称 ___________。
(5)将实验得到的Na2FeO4再加入饱和KOH溶液中,可析出紫黑色的K2FeO4粗晶体,其原因是________________________________________________________。
(6)高铁酸钾纯度检测:称取3.0 g制备的K2FeO4粗晶体溶于适量KOH溶液中,加入足量的KCrO2充分反应(此时Cr元素全部以CrO42- 形式存在),过滤,滤液在100 mL容量瓶中定容。取10.00 mL加人稀硫酸酸化,再用 0.10 mol/L的(NH4)2Fe(SO4)2标准溶液滴定至终点(此时Cr元素全部以Cr3+形式存在),重复滴定3次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4样品的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年9月,中国爆发三鹿毒奶粉事件,其原因是奶粉中含有三聚氰胺。三聚氰胺是一种重要的有机化工原料。它的结构简式如图,下列说法中正确的是

A. 该物质可用作食品添加剂
B. 三聚氰胺属于有机高分子化合物
C. 分子中所有原子都在同一平面上
D. 三聚氰胺含氮量很高,能冒充蛋白质通过检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
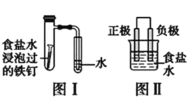
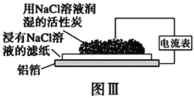
A.按图Ⅰ装置实验,加热具支试管可更快更清晰地得到实验证据—观察到液柱上升
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面白斑可用图Ⅲ装置进行探究,Cl-在铝箔表面区发生电极反应:2Cl- -2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3脱水形成白斑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com