
����Ŀ����ͼװ�ã�A��B�еĵ缫Ϊ��Ķ��Ե缫��C��DΪ����ʪ��Na2SO4��ֽ�����ĵIJ��У���Դ��a��b����������A��B�г���KOH��Һ������KOH��Һ��ˮ���У��ж�K1 �� �պ�K2��K3ֱͨ���磬�ٱ����Դ������������aΪ����bΪ����
����ʪ��Na2SO4��Һ��ֽ�����ĵ�KMnO4Һ�Σ���ʲô���� ��
��д���缫��Ӧʽ��
A�� ��
B�� ��
�������һ��ʱ���A��B�о��������Χ�缫����ʱ�ж�K2��K3 �� �պ�K1 �� ���������ָ���Ƿ��ƶ������ǻ�� �� ��������ָ�벻�ƶ�˵�����ɣ���ָ���ƶ�Ҳ˵������ �� 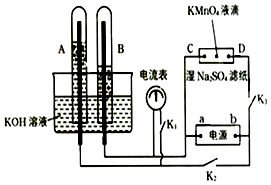
���𰸡�����������ɫ��D�����ƶ������������������4OH����4e=2H2O+O2����4H++4e=2H2�����ǣ��������ȼ�ϵ��
���������⣺���ж�K1 �� �ϱ�K2��K3ֱͨ���磬�缫A��B������������Һ���ɵ��أ��������ӵķŵ�˳����Һ�������ӡ����������ӷŵ磬�ֱ����������������������������������Ϊ2��1��ͨ��ͼ��֪��B�������������A�������������2��������B���ϵ�������A���ϵõ�����������B����������A������������a�Ǹ�����b��������
���Դ��ǣ����������ڽ��������Ƶ���ֽ�͵缫C��D���ԴҲ�����˵��أ���Ϊa�Ǹ�����b������������C��������D���������������Һ�е������Ӽ������������ƶ��������Ӹ�����������������ƶ�������D������ɫ���������Һ�������Ӻ����������ӷŵ磬�����������϶��õ����壮
���Դ��ǣ���ɫ��D�����ƶ��������������������A��������������ʧ��������������ˮ���缫��ӦʽΪ4OH����4e=2H2O+O2����B���������ӵõ��������������缫��ӦʽΪ4H++4e=2H2����
���Դ��ǣ�4OH����4e=2H2O+O2����4H++4e=2H2�������ж�K2��K3 �� �ϱ�K1 �� ���һ��ʱ���A��B�о��������Χ�缫����װ�ù�������ȼ��ԭ��أ������е���ͨ������������ָ���ƶ���
���Դ��ǣ��ǣ��������ȼ�ϵ�أ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��A��B��C��D��E��ԭ��������������A�ĺ����������������������ͬ��B�ļ۵��Ӳ��е�δ�ɶԵ�����3����C��s�ܼ�����������p�ܼ�����������ȣ�D��Cͬ�壻E�������ֻ��1�����ӣ����������18�����ӣ��ش��������⣺
��1��E+���ӵĻ�̬��������Ų�
��2��B��C��D�е�һ�������ɴ�С��˳��Ϊ����Ԫ�ط��ţ�
��3��A��B��C��Ԫ���γɵ����ֹ��ۻ��������Ӧ������BA4+���ӣ������ӵ�����ԭ�ӵ��ӻ���ʽΪ����BA4+���ӻ�Ϊ�ȵ������һ�ַ���Ϊ���ѧʽ����
��4��E����������Һ�еμӹ����İ�ˮ�������������[E��NH3��4]SO4 �� 1mol������к��еĦҼ�����ĿΪ ��
��5��E��C������С��ΪC��ʵ��С��ΪE���γɵ�һ�����ӻ�����ľ���ṹ��ͼ��ʾ�������ӻ�����Ļ�ѧʽΪ �� 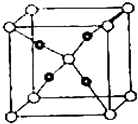
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. þ�Ͻ��ܶ���С����Ӳ�Ⱥ�ǿ�Ƚϴ�
B. �����Ƶ�ˮ��Һ�׳���ˮ����������һ�ֽ�����ҵ���õ��ϼ�
C. ��ˮ�к�����ߵķǽ���Ԫ������Ԫ��
D. ������ά�ڻ�����ȼ�ղ�������ζ��ȷ������ά�Ƿ�Ϊ��������ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ھƾ�������ԭ����
A. �ܽ����� B. ��ԭ���� C. �������� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���� ![]() ���γ�HmX���⻯��� a g HmX ���У� ��
���γ�HmX���⻯��� a g HmX ���У� ��
A.![]() mol����
mol����
B.![]() mol����
mol����
C.![]() mol����
mol����
D.![]() mmol HmX
mmol HmX
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���α������һ������Ѫ�����ŵĽ�Ѫѹҩ����ںϳ��α�����м���G�IJ���������ͼ��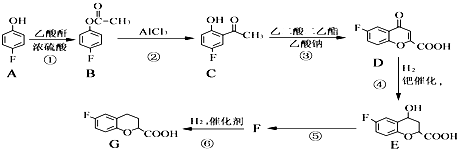
��֪���������Ľṹ��ʽΪ ![]() ��ش��������⣺
��ش��������⣺
��1��G�����еĹ����ŵ��������Ȼ����� ��
��2����ӦA��B�Ļ�ѧ����ʽΪ ��
��3�������ܡ��ݱ仯���̵ķ�Ӧ���ͷֱ����� ��
��4��д����������������C��ͬ���칹��Ľṹ��ʽ����������ֻ������ȡ������������ֻ��4�ֲ�ͬ��ѧ�������⣮
������NaHCO3��Ӧ����CO2 ��
��5����������֪ʶ����������Ϣ��д���� ![]() ��������Ϊԭ���Ʊ�
��������Ϊԭ���Ʊ� ![]() �ĺϳ�·������ͼ�����Լ���ѡ����
�ĺϳ�·������ͼ�����Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ�ģ� ��
A. �Ͻ���۵������ɳɷֽ������۵��
B. SO2����Ư������ʹ��ɫʯ����Һ�ȱ�����ɫ
C. ��Fe��Al��������Ũ���ᷴӦ���ʲ�����Fe��Al������ʢ��Ũ����
D. Һ���ӷ����ܶȴ���ˮ������ʱ����ˮ�ⷨ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���ù�ҵ̼��ƣ���Ҫ�ɷ�ΪCaCO3������Ϊ��Al2O3��FeCO3�� Ϊԭ�ϣ����Ʊ������Σ������������Һ�����ȡ����ƣ������ͼ�������ʵ��ܽ������������ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ1.0molL��1���㣩�����ṩ���Լ��У�a�������ƣ�b.5molL��1���ᣬc.5molL��1���ᣬd.5molL��1���ᣬe.3%H2O2��Һ��f������ʯ��ˮ��
�������� | ��ʼ������pH | ������ȫ��pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
�벹��������̼����Ʊ�����Ƶ�ʵ�鲽��
����1����ȡ13.6g����������Լ20mLˮ�������Һ���ã�����ȡ��ϸ��̼�����Ʒ10g���ã�
����2�� ��
����3�� ��
����4�����˺���Һ���������Һ��ϣ�������ҺpH 7��8����ֽ��裬������Һ������ϴ�Ӹ���ü���ƾ��壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��SO2�����ʣ�����ͼ��ʾװ�ý���ʵ�飮 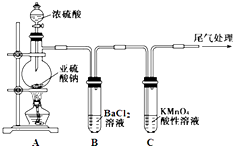
��֪��Na2SO3+H2SO4��Ũ�� ![]() Na2SO4+SO2��+H2O
Na2SO4+SO2��+H2O
��ش��������⣺
��1��װ��A��ʢ��Ũ��������������� ��
��2��ʵ������У�C�е������� �� ˵��SO2�����ԣ�
��3��ʵ������У��۲쵽װ��B�г��������Եİ�ɫ������Ϊ̽���ð�ɫ�����ijɷ֣���С��ͬѧ����������ʵ�飺 ![]()
����ʵ����ʵ�жϸð�ɫ�����ijɷ������ѧʽ���������ð�ɫ������ԭ�������������ĸ��ţ���
a��BaSO3�Ȳ�����ˮҲ�������� b��BaCl2��Һ�п����ܽ�������
c��BaCl2��Һ�п��ܻ���NaOH d����A�Ƶõ�SO2�����п��ܻ�������
��4�������װ��A�е�ŨH2SO4����ŨHNO3 �� �Դ�ʵ���Ƿ���Ӱ�첢������ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com