
【题目】周期表前四周期的元素A、B、C、D、E,原子序数依次增大.A的核外电子总数与其周期数相同,B的价电子层中的未成对电子有3个,C的s能级电子总数与p能级电子总数相等,D与C同族;E的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)E+离子的基态核外电子排布
(2)B、C、D中第一电离能由大到小的顺序为(填元素符号)
(3)A和B、C两元素形成的两种共价化合物发生反应,生成BA4+离子,该离子的中心原子的杂化方式为;与BA4+离子互为等电子体的一种分子为(填化学式).
(4)E的硫酸盐溶液中滴加过量的氨水可以生成配合物[E(NH3)4]SO4 , 1mol配合物中含有的σ键的数目为 .
(5)E和C(空心小球为C,实心小球为E)形成的一种离子化合物的晶体结构如图所示,则离子化合物的化学式为 . 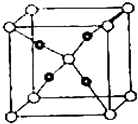
【答案】
(1)1s22s22p63s23p63d10
(2)N>O>S
(3)sp3;CH4
(4)20NA
(5)Cu2O
【解析】解:周期表前四周期的元素A、B、C、D、E,原子序数依次增大,A的核外电子总数与其周期数相同,则A为H元素,C的s能级电子总数与p能级电子总数相等,A和B、C两元素可以形成两种共价化合物,则C为O元素,D与C同族,则D为S元素;B的价电子层中的未成对电子有3个,则B为第ⅤA族元素,B的原子序数小于C,所以B为N元素,E的最外层只有1个电子,但次外层有18个电子,则E为29号Cu元素,(1)Cu+离子核外有28个电子,其基态核外电子排布为1s22s22p63s23p63d10 , 所以答案是:1s22s22p63s23p63d10;(2)B、C、D分别是N、O、S元素中,元素的非金属性越强,其第一电离能越大,同一周期元素中,第一电离能随着原子序数的增大呈增大趋势,但第VA族元素大于相邻元素,所以N、O、S中第一电离能由大到小的顺序为N>O>S,所以答案是:N>O>S;(3)A和B、C两元素形成的两种共价化合物发生反应,生成NH4+离子,该离子的中心原子氮原子的价层电子对数为 ![]() =4,所以氮原子的杂化方式为sp3杂化,与NH4+离子互为等电子体的一种分子为CH4 , 所以答案是:sp3;CH4;(4)在配合物[Cu(NH3)4]SO4中,铜离子与氨分子之间有4个σ键,每个氨分子内部有3个σ键,硫酸根离子中有4个σ键,所以1mol配合物中含有的σ键的数目为(4+4×3+4)NA 个=20NA个,所以答案是:20NA;(5)E和C形成的一种离子化合物的晶体结构如图1,c离子个数=1+8×
=4,所以氮原子的杂化方式为sp3杂化,与NH4+离子互为等电子体的一种分子为CH4 , 所以答案是:sp3;CH4;(4)在配合物[Cu(NH3)4]SO4中,铜离子与氨分子之间有4个σ键,每个氨分子内部有3个σ键,硫酸根离子中有4个σ键,所以1mol配合物中含有的σ键的数目为(4+4×3+4)NA 个=20NA个,所以答案是:20NA;(5)E和C形成的一种离子化合物的晶体结构如图1,c离子个数=1+8× ![]() =2,e离子个数=4,所以该化合物为Cu2O,所以答案是:Cu2O.
=2,e离子个数=4,所以该化合物为Cu2O,所以答案是:Cu2O.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知在298K时下述反应的有关数据:
C(s)+ ![]() O2(g)=CO(g)△H1=﹣110.5kJ/mol
O2(g)=CO(g)△H1=﹣110.5kJ/mol
C(s)+O2(g)=CO2(g),△H2=﹣393.5kJ/mol
则C(s)+CO2(g)=2CO(g)的△H 为( )
A.283.5kJ/mol
B.172.5kJ/mol
C.﹣172.5kJ/mol
D.﹣504 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=﹣890.3kJmol﹣1
②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1
③C(s)+O2(g)═CO2(g)△H=﹣393.5Kjmol﹣1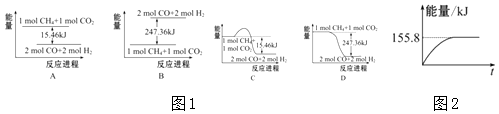
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷气体与O2作用而产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量(填“>”、“<”或“=”)890.3kJ.
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2 , 1g CH4完全反应可释放15.46kJ的热量,则:
①图1(所有物质均为气态)能表示该反应过程中能量变化的是(填字母).
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图2所示,则CH4的转化率为 .
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H= .
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是(填字母).
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2 , 并放出热量
B.将固态碳合成为C60 , 以C60作为燃料
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl﹣)为1.3mol/L,要使Mg2+与Al3+完全分离,至少需加4mol/L的NaOH溶液的体积为( )
A.40mL
B.72mL
C.80mL
D.128mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补充完成下表:
元素 | 甲 | 乙 | 丙 |
元素符号 | ① | ② | O |
原子结构 |
| ③ | ④ |
周期 | 三 | 三 | ⑤ |
族 | ⑥ | ⅦA | ⑦ |
(1)请把序号①一⑦的答案对应填上) ①②③④⑤⑥⑦
(2)甲元素最高价氧化物对应的水化物呈性(填“酸、碱”),乙元素的最高价氧化物对应的水化物的化学式为 .
(3)甲与乙两元素的单质反应生成物的电子式为 , 属于(离子或共价)化合物.
(4)甲单质与丙的氢化物反应的化学方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~E间的转化关系如下图所示。A是石油裂解气的主要成分,其产量通常用来衡量一个国家的石油化工水平。E为生活中常用的有机高分子化合物。

回答下列问题:
(1)A的名称是__________;将A通入溴的四氯化碳溶液中,现象为________。
(2)写出E的结构简式:__________________________。
(3)④的反应类型为______________,写出其化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年世界环境日主题是“人与自然,相联相生” 。下列做法应该提倡的是( )
A. 将工业废液直接排入海洋以减少河道污染 B. 推广使用高效、低毒农药,减轻水体污染
C. 将废旧电池集中深埋,可防止重金属污染 D. 增高燃煤锅炉烟囱,将废气直接排到高空
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,A,B中的电极为多孔的惰性电极;C,D为夹在湿的Na2SO4滤纸条中心的铂夹;电源有a、b两极.若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1 , 闭合K2、K3通直流电,则:①标出电源的正、负极,a为极,b为极.
②在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,有什么现象 .
③写出电极反应式:
A中 .
B中 .
④若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3 , 闭合K1 , 则电流表的指针是否移动(填是或否) . 若电流表指针不移动说明理由,若指针移动也说明理由 . 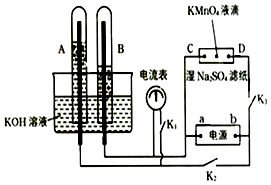
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com